2022-01-10 理化学研究所,東京工業大学,日本医療研究開発機構
理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員(理研科技ハブ産連本部糖鎖ターゲティング研究チーム副チームリーダー、東京工業大学物質理工学院応用化学系教授)、イゴール・ナシブリン特別研究員らの国際共同研究グループは、遷移金属触媒[1]を用いて、マウス体内のがん細胞の近くでベンゼン骨格を持つ抗がん活性物質を合成することにより、がん細胞の増殖抑制に成功しました。
本研究成果は、マウス静脈からがん活性物質の原料を注射投与して、がんの「現場」で抗がん活性物質を合成し、抗がん作用を確認した初めての生体内合成化学治療[2]の例であり、今後の創薬や医療に大きな影響を与えるものと期待できます。
がんの化学療法では、抗がん剤の効果だけでなく、いかに正常組織への副作用を抑えるかが大きな課題となっていました。
今回、国際共同研究グループは、ほとんどの薬剤の基本骨格にはベンゼン環が含まれることに注目し、遷移金属触媒を用いた体内でのベンゼン環合成法を開発しました。がん組織へ選択的に送達されるように設計された遷移金属触媒複合体を用いて、がん細胞の近くで効率的に抗がん活性物質のベンゼン環を合成し、選択的に抗がん作用を発揮させることに成功しました。抗がん活性物質の原料と遷移金属触媒をマウスに静脈から投与するだけでがん細胞の増殖が抑制され、副作用も見られませんでした。
本研究は、オンライン科学雑誌『Nature Communications』の(1月10日付)に掲載予定です。
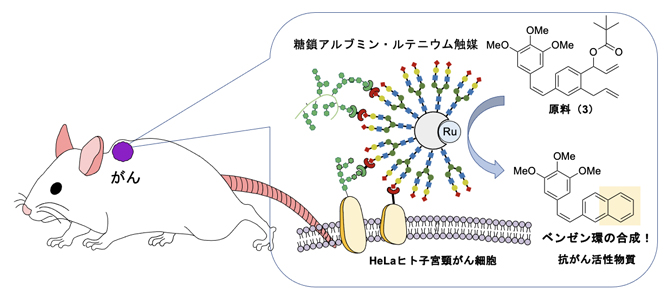
マウス体内のがん細胞で抗がん活性物質のベンゼン環を合成し抗がん作用が発揮される
背景
がんの化学療法は、細胞に対して毒性を示す薬剤(抗がん剤)を投与し、がん組織にダメージを与えることで、がん(悪性腫瘍)の縮小を目指す治療です。しかし、抗がん剤はがん細胞だけでなく正常細胞にも影響を及ぼすことから、さまざまな副作用が現れるという問題があります。正常細胞への影響を減らし、副作用を最小限に抑える手法として、抗がん剤を選択的にがん組織に送達する(薬物送達)、もしくは細胞に対して毒性を持たない化合物(プロドラッグ[3])をがん組織において毒性を示す化合物へと変換する方法などがあります。
これまでに田中克典主任研究員らは、体内遷移金属触媒反応を利用し、プロドラッグの活性化法を開発してきました(図1)。通常、遷移金属触媒を生体に投与すると、グルタチオンなどの触媒毒[4]によってその機能は失われます。しかし、血清アルブミンタンパク質の疎水性ポケットの中へ遷移金属触媒を導入すると、金属触媒が安定化され、生体内においても効率的に触媒反応が進行することを2019年に見いだしました注1)。さらに、アルブミン表面のアミノ基にアスパラギン結合型糖タンパク質糖鎖(N-型糖鎖)を複数個導入することで、アルブミンが「糖鎖パターン認識」の効果により、体内の特定の臓器やがんへと選択的に移行することを見いだしました注2-3)。これらの発見により、2021年にはマウス体内のがんに「糖鎖アルブミン・遷移金属触媒」を移行させ、がん細胞に抗がん活性ペプチドを貼り付ける(タギングする)ことで、副作用なくがんの増殖や転移を抑制することに成功しました注4-5)。
そこで今回、国際共同研究グループは、さらに体内遷移金属触媒反応を展開し、マウス体内のがん細胞の近くで抗がん活性物質を合成することにより、がんを治療することに挑みました。
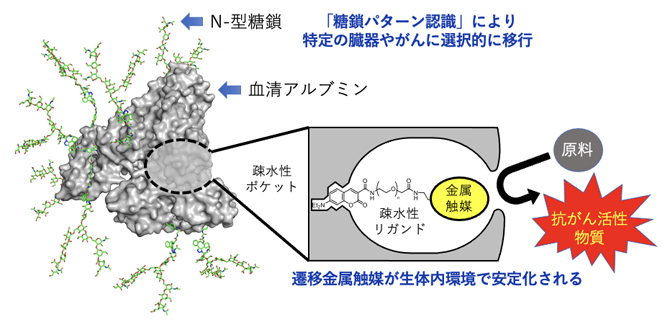
図1 マウス体内のがんで機能する体内遷移金属触媒反応
血清アルブミンの疎水性ポケットの中へ遷移金属触媒を導入すると、金属触媒が安定化され、生体内においても効率的に触媒反応が進行する。さらに、アルブミン表面のアミノ基にN-型糖鎖を複数個導入することで、糖鎖アルブミン・金属触媒が体内の特定の臓器やがんへと選択的に移行し、その場で金属触媒反応を行うことができる。
注1)2019年7月2日プレスリリース「触媒的「現地合成」によるがん治療」
注2)2018年7月4日プレスリリース「がんを糖鎖のパターンで認識」
注3)2020年10月21日プレスリリース「糖鎖の不均一性を秩序よく高次化してがんを見つける」
注4)2021年4月24日プレスリリース「世界初のマウス体内におけるタギング治療」
注5)2021年9月2日プレスリリース「たった1回の投薬で効く体内触媒戦法」
研究手法と成果
ほとんどの薬剤には、共通の骨格としてベンゼン環が含まれています。これは、ベンゼン環の疎水性やπ電子[5]が、薬剤のターゲットとなるタンパク質と相互作用するときに重要な役割を果たすからです。そこで国際共同研究グループは、体内遷移金属触媒反応を活用して、マウス内のがん細胞の近くでベンゼン環を合成することを計画しました。この際に、ルテニウム触媒による分子内でのメタセシス反応[6]に続く脱水を経たベンゼン環形成反応を利用しました(図2)。
まず、図2に示したルテニウム触媒(1)を用いてフラスコ内で反応を検証したところ、二つの二重結合と水酸基を持つ原料から、ナフタレン、ビフェニル、ヒドロキノン、アントラセン、カルバゾール、ベンゾチオフェン、フェナントレンなど、さまざまなベンゼン誘導体を合成できました。
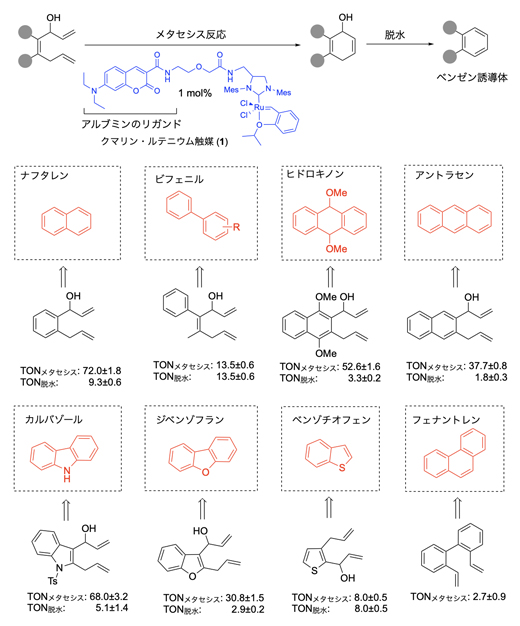
図2 ルテニウム触媒によるメタセシス反応と脱水を経たさまざまなベンゼン環の合成
TON(触媒回転数)の値は、メタセシス反応ならびに脱水反応において、触媒1モルあたり変換できる物質のモル数を示す。
次に、このように開発した方法で抗がん活性物質(2)を生体内合成することを試みました(図3)。抗がん活性物質(2)は、天然物のコンブレタスタチンA-4の誘導体であり、ナノモーラー(nM、1nMは10億分の1モーラー)レベルの解離定数[7]で細胞内の微小管を構成するβ-チューブリン[8]と結合します。その結果、β-チューブリンの重合を阻害してがん細胞の増殖を著しく抑制します。そこで、原料(3)を設計し、抗がん活性物質(2)の一つのベンゼン環を生体内のがん細胞の近くで合成することで、がんで選択的に抗がん活性を発揮させられると考えました。
この際、原料(3)の水酸基に導入したターシャリーブチルエステル基[9]は、その大きな置換基の効果により、β-チューブリンと結合できないように設計しました。これは、原料(3)が正常組織のβ-チューブリンと結合してしまうと副作用が起こるためです。一方で、ターシャリーブチルエステル基の高い疎水性の効果により、体内遷移金属触媒であるアルブミンの疎水性ポケットに入りやすくしてメタセシス反応の触媒活性を上げることができます。さらに、血中内での酵素分解には安定でありますが、脱水反応を起こしやすいターシャリーブチルエステル基にすることにより、メタセシス反応の後、ベンゼン環がより効率的に得られることを期待しました。
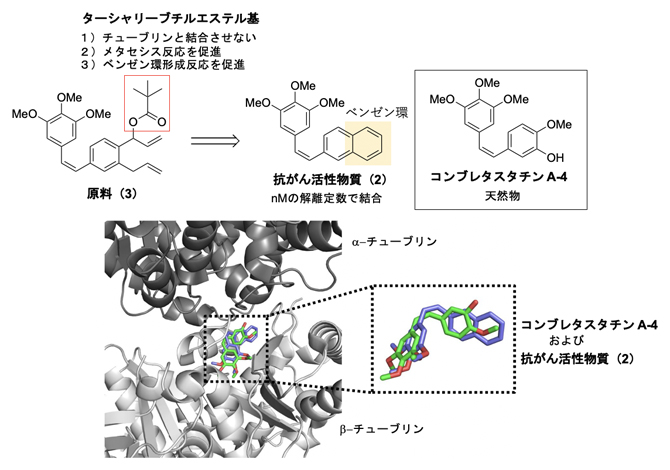
図3 体内遷移金属触媒反応を用いた抗がん活性物質のデザイン
体内遷移金属触媒を用いて、コンブレタスタチンA-4天然物の誘導体である抗がん活性物質(2)のベンゼン環部分を原料(3)から合成する。抗がん活性物質(2)は、β-チューブリンと結合してがんを阻害する。
まず、図2で検討したルテニウム触媒(1)を生体内環境下で安定化するために、アルブミンの疎水性ポケットの中へ導入しました(図4)。さらにアルブミンの表面に対してHeLaヒト子宮頸がん細胞に選択的に結合することが分かっているα(2,6)シアリル化糖鎖を導入しました。HeLaがん細胞に対して、糖鎖アルブミン・ルテニウム触媒と原料(3)を作用させたところ、がん細胞の近くで抗がん活性物質(2)が効率的に生成し、著しい毒性を示すことが分かりました(図4)。詳細な検討から、原料(3)から抗がん活性物質(2)へと変換されることによって、がん細胞の増殖速度阻害活性(GR50)[10]が約1,000倍も向上し、がん細胞の増殖を効率的に抑制することが分かりました。
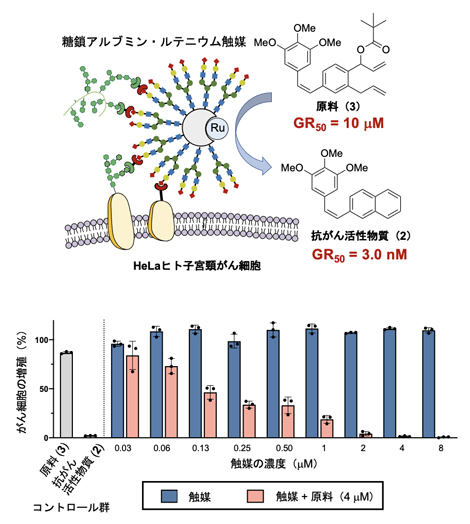
図4 HeLaがん細胞に対する抗がん活性物質の合成(上)とがん細胞の増殖抑制効果(下)
上)HeLaがん細胞表面に移行した糖鎖アルブミン・ルテニウム触媒により、原料(3)から抗がん活性物質(2)が生成する。その際、GR50値(最大増殖速度を50%に減少させる濃度)は10μMから3.0nMに減少し、これは増殖速度阻害活性が約3,000倍に向上したことを示す。GR50値は、細胞の増殖速度(生育量)を50%阻害するために必要な化合物の濃度を示す。
下)HeLaがん細胞に触媒だけを加えても細胞の増殖に変化はないが(青色のカラム)、さらに4μMの原料(3)を添加すると、触媒の濃度依存的に抗がん活性物質(2)が生成する結果、増殖を著しく低下させる(赤色のカラム)。
さらに、マウス個体のがんモデルで体内金属触媒反応を行って、抗がん活性物質(2)による治療効果を評価しました(図5)。HeLa細胞を移植した担がんマウス[11]を5匹ずつ4群に分け、各マウスに①生理食塩水、②原料(3)のみ、③触媒のみ、④触媒と原料(3)の両方をそれぞれ静脈内に注射投与し、腫瘍の成長を比較しました。その結果、①~③のコントロールマウス群では腫瘍の成長がほとんど抑制されなかったのに対し、④のマウス群では、腫瘍の成長が著しく抑えられることが分かりました。また、副作用は見られませんでした。この結果から、マウスに移植したがんでも、がんで選択的に体内遷移金属触媒反応を実施して抗がん活性物質(2)を合成することにより、がんを治療できることが分かりました。
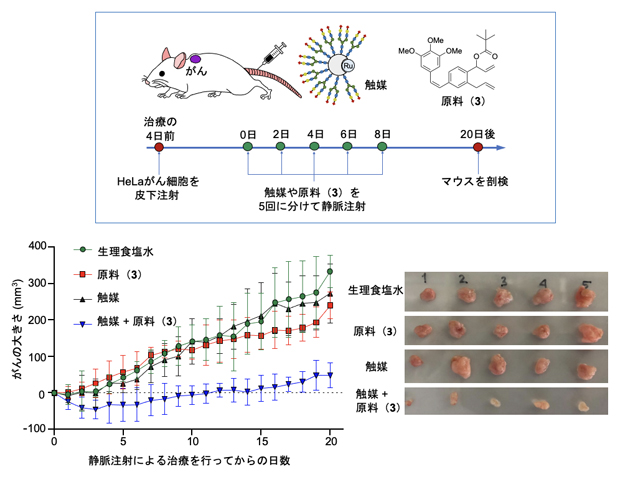
図5 がん移植マウスへの静脈投与によるがん治療実験
生理食塩水、原料(3)のみ、または触媒のみを投与した対照群(グラフ:緑、赤、黒)では、腫瘍が増大したのに対して、原料(3)と触媒を共に投与して、がんで抗がん活性物質(2)を生体内合成したマウス(グラフ:青)では、腫瘍の成長が抑制され(左図)、副作用の指標であるマウスの体重減少も見られなかった。右図はマウスから摘出した20日後の腫瘍。
今後の期待
本研究成果は、静脈から金属触媒と薬剤の原料を注射投与し、がんの「現場」で抗がん活性物質を合成して治療した初めての例となりました。国際共同研究グループの糖鎖アルブミン・遷移金属触媒を使用することで、今後はベンゼン環だけでなく、さまざまな分子が体内で合成できると考えられます。
これまでに実現した体内タギング治療法と併せて注4-5)、体内遷移金属触媒反応をより現実的ながん治療へと発展することが可能になりました。今後、生体内合成化学治療の概念ががん治療における有用な治療基盤の一つとして発展するものと期待できます。
補足説明
1.遷移金属触媒
周期表の第3族から第11族までに属する遷移金属元素の触媒。これらの元素は特定の官能基に対して強い親和性を示すため、さまざまな有機化学反応を触媒することが知られている。
2.生体内合成化学治療
通常はフラスコの中で行われる複雑な有機合成化学反応を、生体内(疾患部位)で行い、治療薬を体内で直接合成することで疾患を治療する手法。
3.プロドラッグ
生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤。標的部位選択的に活性を示すことから、副作用の軽減が期待できる。標的部位での化学反応には、生体内の酵素による触媒反応や生体内の低分子との反応が主に用いられる。
4.触媒毒
触媒の作用を減退または消失させる物質。チオール基を含むグルタチオンが代表的な生体内の触媒毒である。
5.π電子
二重結合や三重結合などのπ結合を形成する電子。
6.メタセシス反応
二重結合や三重結合の間で、結合の組み換えが起こる反応。
7.解離定数
分子複合体がその構成分子に解離する傾向を示す平衡定数であり、値が小さいほど複合体の形成がより好ましいことを示す。
8.β-チューブリン
チューブリンは細胞内の微小管や中心体を形成するタンパク質であり、α-チューブリン、β-チューブリン、γ-チューブリンの3種類がある。
9.ターシャリーブチルエステル基
ターシャリーブチル基〔-C(CH3)3〕を持つエステル基であり、嵩(かさ)高く、疎水性が高い性質を持つ。
10.増殖速度阻害活性(GR50)
細胞の増殖速度(生育量)を50%阻害するために必要な化合物の濃度。
11.担がんマウス
がん細胞を免疫不全マウス(免疫に欠陥があるマウス)へ移植した実験モデル。
国際共同研究グループ
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(理研科技ハブ産連本部 糖鎖ターゲティング研究チーム 副チームリーダー、東京工業大学 物質理工学院 応用化学系 教授)
特別研究員 イゴール・ナシブリン(Igor Nasibullin)
国際プログラム・アソシエイト(研究当時) イヴァン・スミルノフ(Ivan Smirnov)
特別研究員(研究当時) ペニー・アーマディ(Peni Ahmadi)
研究員(研究当時) ケンワード・ヴォン(Kenward Vong)
(理研科技ハブ産連本部 糖鎖ターゲティング研究チーム 研究員)
カザン大学 生体機能化学研究室(理研-カザン連携研究室)
准教授 アルミラ・クルバンガリエバ(Almira Kurbangalieva)
研究支援
本研究は、日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「糖鎖付加人工金属酵素による生体内合成化学治療(研究代表者:田中克典)」による支援を受けて行われました。
原論文情報
Igor Nasibullin, Ivan Smirnov, Peni Ahmadi, Kenward Vong, Almira Kurbangalieva, Katsunori Tanaka, “Synthetic prodrug design enables biocatalytic activation in mice to elicit tumor growth suppression”, Nature Communications, 10.1038/s41467-021-27804-5
発表者
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(理研 科技ハブ産連本部 糖鎖ターゲティング研究チーム 副チームリーダー、東京工業大学 物質理工学院 応用化学系 教授)
特別研究員 イゴール・ナシブリン(Igor Nasibullin)
報道担当
理化学研究所 広報室 報道担当
東京工業大学 総務部 広報課
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当