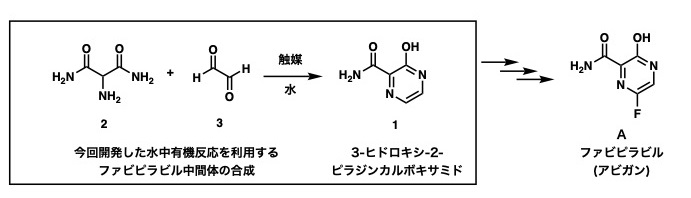
2020-05-21 理化学研究所,順天堂大学,日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センター細胞機能探索技術研究チームの宮脇敦史チームリーダー(光量子工学研究センター生命光学技術研究チームチームリーダー)、片山博幸研究員、順天堂大学医学部の日置寛之准教授らの共同研究グループ※は、損傷したミトコンドリアを細胞が選択的に除去する現象「マイトファジー[1]」を可視化する蛍光センサーを開発し、パーキンソン病の病理診断および治療薬開発に応用しました。
本研究成果は、パーキンソン病を含む神経変性疾患、さらにミトコンドリア機能障害が関与するあらゆる疾患の医学的研究に役立つと期待できます。
細胞には、ストレスで損傷したミトコンドリアをリソソーム[2]に送り分解する機構(マイトファジー)が備わっています。このマイトファジーが正常に働かないと、パーキンソン病などさまざまな疾患が起こることが分かっています。
今回、共同研究グループは、酸やタンパク質分解酵素[2]に耐性を持つ蛍光タンパク質「TOLLES[3]」を作製し、TOLLESを材料にしてマイトファジーを定量的に可視化する蛍光センサー「mito-SRAI」を開発しました。このセンサーを用いて、パーキンソン病モデルマウス中脳のドーパミン神経[4]において、マイトファジー不全と細胞死が相関することを示しました。さらに、76,000種の化合物の中からパーキンソン病治療薬の候補を見いだすことに成功しました。
本研究は、科学雑誌『Cell』(5月28日号)の掲載に先立ち、オンライン版(5月20日付:日本時間5月21日)に掲載されます。
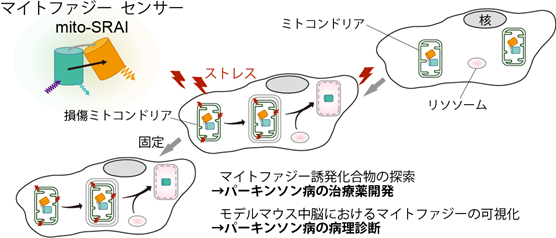
マイトファジー蛍光センサーにより、パーキンソン病の治療薬や病理診断の開発が可能に!
- ※共同研究グループ
-
- 理化学研究所
-
- 脳神経科学研究センター 細胞機能探索技術開発チーム
- チームリーダー 宮脇 敦史 (みやわき あつし)
(光量子工学研究センター 生命光学技術研究チーム チームリーダー) - 研究員 片山 博幸 (かたやま ひろゆき)
- 研究員 濱 裕 (はま ひろし)
- 研究員 黒川 裕 (くろかわ ひろし)
- 研究員 杉山 真由 (すぎやま まゆ)
- 研究員 安藤 亮子 (あんどう りょうこ)
- 武田薬品工業株式会社 リサーチニューロサイエンス創薬ユニット
- リサーチマネージャー 辻畑 善行 (つじはた よしゆき)
- 主席研究員 長澤 孝治 (ながさわ こうじ)
- 主席研究員 本間 実咲 (ほんま みさき)
- 主任研究員 船田 雅昭 (ふなた まさあき)
- 主任研究員 西村 鷹則 (にしむら たかのり)
- 順天堂大学医学部 神経生物学・形態学講座
- 准教授 日置 寛之(ひおき ひろゆき)
- 特別研究学生 高橋 慧(たかはし めぐむ)
- 研究員 石田 葉子(いしだ ようこ)
- 研究支援
- 本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域「共鳴誘導で革新するバイオイメージング(領域代表者:宮脇敦史)」および日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」の支援を受けて行われました。
背景
真核生物の細胞は、飢餓状態における栄養源を確保するために、自らの細胞内成分をリソソームという細胞小器官に送り込んで分解する「オートファジー[5]」という機構を備えています。リソソーム内は酸性のため、オートファジーが進むにつれ、分解される成分の周りのpHは中性から酸性へと変化します。宮脇敦史チームリーダーらは2011年に、励起波長がpHに依存して変化する蛍光タンパク質Keima[6]を用いて、オートファジーによる分解の総和量を検出・可視化する蛍光センサーを開発しました注1)。
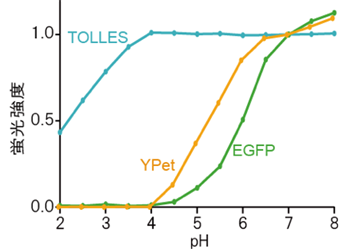
図1 さまざまな蛍光タンパク質のpH滴定一般に蛍光タンパク質の蛍光強度は環境のpHに応じて増減するが、酸に耐性を持つTOLLESの蛍光強度はpH4~8の範囲でほとんど変化しない。pHの変化による蛍光タンパク質の蛍光強度の変化には可逆的なものと不可逆的なものとがあるが、こうしたpH滴定曲線のほとんどは、可逆的なpH感受性を表している。実際に、蛍光強度の測定はpH調整直後に行われる。本研究ではTOLLESとYPetを用いた。参照として、世界で最も利用されているオワンクラゲ由来のEGFPのpH滴定曲線を示した。
ミトコンドリアはエネルギーを作り出す細胞小器官ですが、ストレスを受けると有毒な活性酸素を産生して自身を傷つけることがあります。損傷したミトコンドリアは、さらに活性酸素を放出し細胞を死に至らせるので、速やかに隔離・分解される必要があります。これまでの研究により、損傷ミトコンドリアには目印が付けられて識別され、オートファジーによって分解されることが分かっています。損傷ミトコンドリアに対して選択的に起こるオートファジーは、「マイトファジー」と呼ばれています。宮脇敦史チームリーダーと片山研究員らは2011年に、Keimaをミトコンドリア内部に設置することで、マイトファジーを簡便に検出・可視化する蛍光センサーを開発しました注1)。
Keimaをもとに開発したセンサーは、リソソーム内外のpH差を検出するため、生きた細胞標本においてのみ機能します。ホルマリンなどで標本を化学的に固定すると、リソソーム内も中性となり、オートファジーやマイトファジーのシグナルが消失してしまうからです。ところが、実験動物を扱う実験では固定組織標本を観察することが多く、また、培養細胞を扱うドラッグスクリーニング実験では、膨大な量の固定細胞標本を観察することが一般的です。このような理由から、固定標本でも機能する蛍光センサーが求められていました。
注1)Katayama H, Kogure T, Mizushima N, Yoshimori T, Miyawaki A. (2011) A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem. Biol. 18, 1242-1052.
研究手法と成果
リソソーム内には、大量の酸とタンパク質分解酵素が存在します。共同研究グループはまず、こうした環境でも全く影響を受けない蛍光タンパク質の作製を目指しました。そもそも蛍光タンパク質の酸に対する感受性には、「可逆的」と「不可逆的」の二つがあります。可逆的な感受性は、蛍光タンパク質の発色団の素早いイオン化反応[7]により説明されます。一方、不可逆的な感受性は、蛍光タンパク質全体の樽形の立体構造が酸によってゆっくりと変性することで説明されます。後者は不可逆的な変化であるため、中性にしても蛍光活性は回復しません。さらに、蛍光タンパク質はタンパク質分解酵素により分解され、この反応も不可逆的であり、いったん分解されると何を施しても蛍光活性は回復しません。
こうした多様な感受性を考慮しながら、あるサンゴ由来の蛍光タンパク質をもとに、リソソームの酸・タンパク質分解酵素に満ちた環境に耐える、シアン色の蛍光タンパク質「TOLLES」を作製することに成功しました(図2左)。また、リソソーム環境に敏感な蛍光タンパク質として、オワンクラゲ由来の緑色タンパク質(GFP)の変異体で、黄色の蛍光タンパク質「YPet[8]」にも着目しました。YPetは、可逆的にも不可逆的にも酸によって蛍光を失い、またタンパク質分解酵素によって分解されます(図2右)。
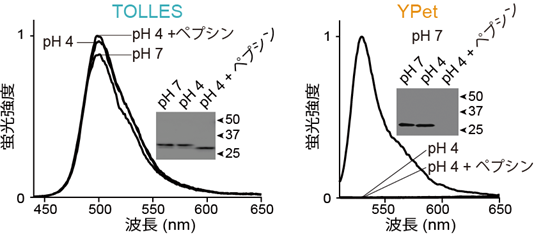
図2 TOLLESとYPetの酸およびタンパク質分解酵素に対する耐性pH7(中性)、pH4(酸性)、pH4+ペプシン(酸性+タンパク質分解酵素)の3条件で、TOLLESもしくはYPetを37℃、18時間保温し、pH7に中和した後、蛍光スペクトル取得(グラフ)とタンパク質の存在を検出するウエスタンブロッティングを行った(四角内の画像)。
(左)TOLLESは、3条件の全てにおいて消光も分解も起こらなかった。
(右)YPetは、pH4で完全に不可逆的に消光し、pH4+ペプシンで完全に分解された。
そこで、TOLLESとYPetを連結し、異なる2波長の蛍光強度の比により定量を可能にするレシオメトリック[9]型のオートファジーセンサー「Signal Retaining Autophagy Indicator;SRAI」を開発しました。SRAIの作動原理の概念図を図3に示します。SRAIを発現する培養細胞を飢餓状態にさらしたところ、オートファジーの進行に従ってSRAIを含む細胞内成分がリソソームに運ばれ、リソソームのタンパク質分解酵素によってYPetのみ分解が進んだ結果、TOLLES/YPetのレシオ値(比値)が上がるのが観察されました。こうした変化シグナルは、標本固定によりリソソーム内が中性になった後も消えずに残ります。
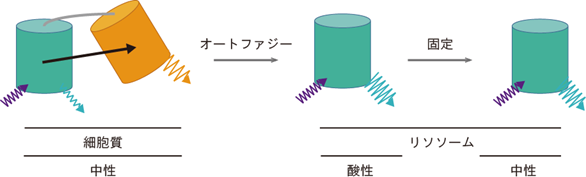
図3 オートファジーの蛍光センサーSRAIの作動原理TOLLESとYPetを、それぞれシアン色、黄色の樽で示している。もともと両者は連結されている。
(左)普段は、TOLLESからYPetへエネルギー移動が起こる結果、TOLLESの蛍光強度が低下する。
(中)オートファジーによりSRAIを含む細胞内成分がリソソーム内に運ばれると、YPetのみが分解される。その結果、エネルギー移動が解除されTOLLESの蛍光強度が回復する。
(右)標本の固定によりリソソーム内が中性になっても、蛍光シグナルは維持される。
次に、マイトファジーの可視化を目指し、オートファジーセンサーSRAIに改良を加え、ミトコンドリア内部に特異的に局在するように工夫しました。タンパク質のミトコンドリアへの移行をつかさどるシグナル[10](アミノ酸配列)とともに、ミトコンドリアへ移行できなかったタンパク質を分解するシグナル[11](アミノ酸配列)をSRAIに付加することで、マイトファジーを定量的に可視化する蛍光センサー「mito-SRAI」を完成させました(図4)。
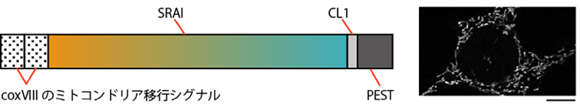
図4 ミトコンドリア特異的局在をきわめたマイトファジー蛍光センサーmito-SRAI(左)SRAIのN末端側にcoxVIIIのミトコンドリア移行シグナルを重ねて付加し、さらに、C末端側にミトコンドリア移行が果たせなかったタンパク質を積極的に分解するシグナルのデグロン配列(CL1、PEST)を付加した。coxVIII のシグナル付加によってSRAIはミトコンドリアに移行できる「mito-SRAI」となり、CL1とPESTの付加によって、ミトコンドリアに移行できず細胞質に漏れたmito-SRAIは速やかに分解される。
(右) mito-SRAIを発現する培養細胞の共焦点レーザー走査顕微鏡による観察画像。白く見えるのがmito-SRAIを含むミトコンドリア。スケールバーは20mm(1μmは1,000分の1mm)。
mito-SRAIを発現する培養細胞に、FCCPという脱共役剤[12]を投与してミトコンドリア機能不全を作り出し、共焦点レーザー走査顕微鏡[13]で観察しました。すると、損傷が起こりマイトファジーによってリソソームに送り込まれたミトコンドリアと、まだ健常なミトコンドリアとを明瞭に区別する画像が得られました(図5)。
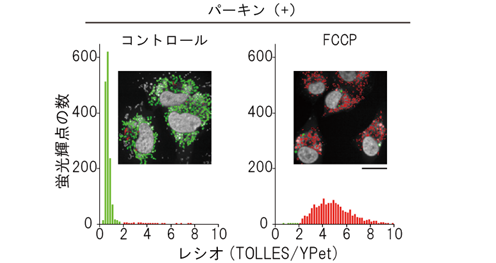
図5 mito-SRAIを用いた培養細胞におけるマイトファジーの検出と定量マイトファジーに必要なタンパク質パーキンとmito-SRAIを発現する培養細胞を用いて、マイトファジーを検出・定量した。四角内の共焦点レーザー走査型顕微鏡像は、TOLLES/YPetのレシオ(比)が2以下を緑色、2以上を赤色で示したレシオ画像である。白色は細胞核を示す。コントロールのミトコンドリアは緑色を示すが、脱共役剤FCCPでマイトファジーを誘導するとミトコンドリアはリソソームに移行し、それに伴ってTOLLES/YPetのレシオが上昇し、赤色を呈するようになる。赤色と緑色の面積比を取ることでマイトファジー量を定量した。スケールバーは20mm。
パーキンソン病は、中脳黒質緻密部[14]にあるドーパミン神経が脱落し、脳内のドーパミンが減ることによって発症します。しかし、その発症過程におけるマイトファジーの関与については、これまで明解な知見がありませんでした。
そこで、6-ヒドロキシドーパミン(6-OHDA)[15]という神経毒を使ってパーキンソン病モデルマウスを作製し、その中脳黒質緻密部におけるマイトファジーをmito-SRAIを用いて観察しました。その結果、6-OHDAを投与して1~3日経ったパーキンソン病モデルマウスでは、組織切片内にマイトファジーのシグナルが散見されましたが、それらはドーパミン神経以外の神経細胞種に限られることが分かりました(図6)。すなわち6-OHDAストレスを受けて生成した損傷ミトコンドリアが、ドーパミン神経では分解・除去されない様子が捉えられたのです。こうしたマイトファジー不全によって、ドーパミン神経細胞の死がもたらされると推測されます。
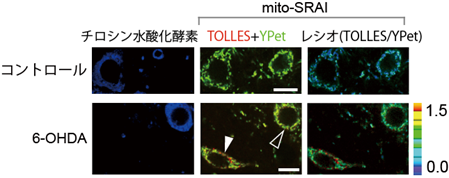
図6 mito-SRAIを用いた中脳黒質緻密部におけるマイトファジーの検出神経細胞特異的にmito-SRAIを発現したマウスの中脳に、6-OHDAを投与して3日後に出来上がったパーキンソン病モデルマウスの中脳黒質緻密部の画像。重ね合わせ画像(TOLLES+YPet)およびレシオ画像(TOLLES/YPet)で、赤色の部分がマイトファジーシグナルを示す。スケールバーは10 mm。
上段:コントロールマウスでは、チロシン水酸化酵素(ドーパミン神経のマーカー)の存在の有無にかかわらず、マイトファジーシグナルは検出されなかった。
下段:6-OHDA投与マウスでは、マイトファジーシグナルは、チロシン水酸化酵素が存在しない神経細胞で検出されたが(白矢頭)、チロシン水酸化酵素が存在するドーパミン神経では検出されなかった(黒矢頭)。
以上の結果から、マイトファジーを人為的に引き起こすことで、ドーパミン神経の死を回避しパーキンソン病を治療できる可能性が示されました。そこで、mito-SRAIを用いて、化合物の大規模ライブラリーのスクリーニングを行いました。さまざまな条件を順に設定し、正常ミトコンドリアには作用しないが損傷ミトコンドリアには作用して、マイトファジーを引き起こす化合物を探しました。その結果、76,000種からなる化合物ライブラリーから、選定基準を満たすマイトファジー誘起薬の候補「T-271」を見いだすことに成功しました(図7)。T-271が細胞毒性を持たないこと、すなわち細胞の主要なエネルギー生成回路(ミトコンドリア呼吸および解糖)に影響を与えないことも確認しています。
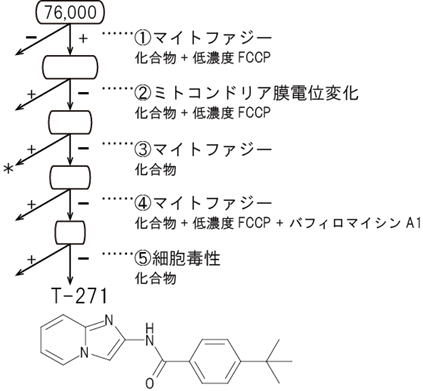
図7 マイトファジー誘起化合物スクリーニングのフローチャートmito-SRAIを発現する培養細胞を用い、76,000種の化合物からなるライブラリーをスクリーニングして、マイトファジー誘起化合物を探索した。その結果、損傷ミトコンドリア特異的にマイトファジーを誘導する候補化合物「T-271」を見いだした。①損傷ミトコンドリアを作るために低濃度FCCPを添加し、マイトファジーを誘起する化合物を選出。②①のうち、ミトコンドリア膜電位変化を起こさない化合物を選出。③②のうち、単独でマイトファジーを起こす化合物は、正常ミトコンドリアに損傷を与えると考えられるため除外。④③のうち、オートファジー阻害薬のバフィロマイシンA1存在下でマイトファジーシグナルを出す化合物を除外。⑤候補化合物が細胞毒性を持たないことを確認。
今後の期待
ミトコンドリアの品質管理に携わるマイトファジーは、脳において神経変性を防ぐ役割を担っています。マイトファジー不全は、パーキンソン病以外にも、アルツハイマー病や筋萎縮性側索硬化症などの神経変性疾患で関与が示唆されています。
mito-SRAIの利点として、生きた状態と固定状態で同じシグナルを示すことが挙げられます。例えば、蛍光内視鏡[16]などを使って生きた動物脳のある部位におけるマイトファジーを経時的に調べ、固定後に脳全体のマイトファジーや細胞死などを包括的に観察すれば、これらのデータを総合的に比較検討できます。マイトファジーと神経細胞死は異なる時間スケールで起こりますが、このように時間的空間的に縦横を貫く研究を徹底すれば、神経変性に関わる諸現象の間の因果関係を理解できると考えられます。
神経変性疾患以外に心筋症や糖尿病などの疾患においても、マイトファジー機能不全の関与が示唆されています。共同研究グループは、mito-SRAIを条件的(部位特異的あるいは時間特異的)に発現するトランスジェニックマウスを作製しています。生きた細胞標本および固定標本の両方におけるマイトファジー可視化技術の普及によって、さまざまな疾患におけるミトコンドリア品質管理の動態の理解が進むと期待できます。
mito-SRAIはマイトファジーに関する確かな定量的情報を提供し、本研究で実証したように、大規模ドラッグスクリーニングの場で力を発揮します。mito-SRAIを巡るライセンス事情は単純明快ゆえ、産業界への速やかな普及が想定されます。産学が協力しマイトファジーを制御する薬を多様に開発することで、それほど遠くない将来に、疾患の予防・治療法が飛躍的に進展すると期待できます。
論文情報
- タイトル
- Visualizing and modulating mitophagy for therapeutic studies of neurodegeneration
- 著者名
- Hiroyuki Katayama, Hiroshi Hama, Koji Nagasawa, Hiroshi Kurokawa, Mayu Sugiyama, Ryoko Ando, Masaaki Funata, Nobuyo Yoshida, Misaki Homma, Takanori Nishimura, Megumu Takahashi, Yoko Ishida, Hiroyuki Hioki, Yoshiyuki Tsujihata, Atsushi MIyawaki
- 雑誌
- Cell
- DOI
- 10.1016/j.cell.2020.04.025
補足説明
- [1] マイトファジー
- 損傷ミトコンドリアを選択的に標識・隔離し、リソソームで分解する品質管理システム。この選択的標識には、タンパク質パーキンが関与している。パーキンの遺伝子変異は、一部の家族性若年性パーキンソン病の原因である。
- [2] リソソーム、タンパク質分解酵素
- 「リソソーム」は細胞内消化を担う細胞小器官。「タンパク質分解酵素」は、タンパク質のペプチド結合を加水分解する酵素の総称。リソソーム内には多くのタンパク質分解酵素が含まれており、タンパク質や細胞小器官のリサイクルに関与している。
- [3] TOLLES
- 強いpH耐性を持ち、リソソーム内でも分解されない蛍光タンパク質。沖縄で採集した石サンゴに由来する蛍光タンパク質アザミグリーンに、アミノ酸変異を導入して得られる。励起のピーク波長は406nm、蛍光のピーク波長は499nmである。TOLLESは、 TOLerance of Lysosomal EnvironmentSの大文字をとって本研究グループが命名した。
- [4] ドーパミン神経
- 神経伝達物質のドーパミンを放出する神経細胞。パーキンソン病では、中脳黒質緻密部のドーパミン神経が脱落することが知られている。
- [5] オートファジー
- 酵母を含め真核生物の細胞が普遍的に備える機構。リソソームにより、細胞内のタンパク質や細胞小器官を分解する。一般的には、飢餓状態のとき自己消化することで栄養源を確保する役割が有名だが、細胞のがん化の抑制や細胞質内に侵入した病原体の排除など、さまざまな場面で細胞の恒常性維持に関与している。オートファジーの仕組みの解明によって、大隅良典博士が2016年のノーベル生理学医学賞を受賞した。
- [6] Keima
- 沖縄で採集した石サンゴに由来する色素タンパク質に、アミノ酸変異を導入して得られた蛍光タンパク質。大きなストークスシフト(励起波長ピークと蛍光波長ピークの差)を持つことが特徴。励起波長ピークには440nmと586nmがある。酸性環境下で586 nmピークが増強、440nmピークが減弱するため、二つの励起ピーク高の比をとることで定量的なpHプローブとして利用できる。Keimaはリソソーム内でも、安定して蛍光を発する。
- [7] 蛍光タンパク質の発色団の素早いイオン化反応
- 一般的に、蛍光タンパク質の発色団には、アミノ酸チロシンに由来するフェノール性水酸基が存在する。この水酸基がプロトン(水素イオン)を受け取ったり放出したりすることで、蛍光タンパク質の光吸収が変化し、蛍光タンパク質の蛍光強度が変化する。これは基本的に可逆的な反応といえる。
- [8] YPet
- オワンクラゲ由来の緑色蛍光タンパク質(GFP)に、アミノ酸変異を導入して得られた蛍光タンパク質。励起の波長ピークは517nm、蛍光の波長ピークは530nmで、黄色の蛍光を強く発する。
- [9] レシオメトリック
- 異なる2波長の蛍光強度の比(レシオ)により定量を行う方法。蛍光プローブの局在濃度のばらつき、試料の形状変化などによる信号の歪み・誤りを軽減できる。
- [10] ミトコンドリアへの移行をつかさどるシグナル
- ミトコンドリアで働くために、細胞質内で作られたタンパク質がミトコンドリアに移行するために持つアミノ酸配列のこと。理論的には、この配列(シトクロムcオキシダーゼサブユニットのcoxVIII)を付加することで、任意のタンパク質をミトコンドリアに移行させることができる。
- [11] ミトコンドリアに移行できなかったタンパク質を分解するシグナル
- プロテアソームという細胞内タンパク質分解システムで積極的に分解されるためのアミノ酸配列のこと。デグロン配列と呼ばれ、本研究ではCL1とPESTという配列を使用した。
- [12] 脱共役剤
- ミトコンドリアにおいて膜電位差を解消させる物質の総称。脱共役剤投与により、ミトコンドリアの電子伝達系とATP合成系の共役が阻害される結果、細胞はATPを合成できなくなる。
- [13] 共焦点レーザー走査顕微鏡
- 理想的な点光源としてレーザーを用い、対物レンズの焦点における蛍光シグナルを検出する。レーザーを走査することで、光学的なスライス蛍光画像を取得する。細胞や組織のような厚みがある標本においても、鮮明なイメージが得られる。
- [14] 中脳黒質緻密部
- 中脳に存在する神経核。ヒトでは色素ニューロメラニンを多く含み、黒く見えるためこう呼ばれる。パーキンソン病では、黒質緻密部のドーパミン神経が特異的に脱落することが知られており、ドーパミン量の不足がパーキンソン病の症状を引き起こすと考えられている。
- [15] 6-ヒドロキシドーパミン(6-OHDA)
- マウスやラットなどの実験動物に投与することで、パーキンソンモデルを作製できる神経毒。
- [16] 蛍光内視鏡
- 励起、蛍光観察が可能な内視鏡。実験動物の脳深部を長時間にわたって観察するのに頻用されている。ある程度の侵襲を伴う蛍光観察法。
発表者
理化学研究所 脳神経科学研究センター 細胞機能探索技術研究チーム
チームリーダー 宮脇 敦史(みやわき あつし)
(光量子工学研究センター 生命光学技術研究チーム チームリーダー)
研究員 片山 博幸(かたやま ひろゆき)
順天堂大学医学部 神経生物学・形態学講座
准教授 日置 寛之(ひおき ひろゆき)
機関窓口
理化学研究所 広報室 報道担当
順天堂大学 総務局 総務部 文書・広報課
AMED事業について
日本医療研究開発機構
疾患基礎研究事業部 疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト担当