2019-09-24 京都iPS細胞研究所
ポイント
- ヒトiPS細胞から、機能的・形態的に成熟した神経筋接合部注1)を作製した。
- この神経筋接合部を用いることによって、神経筋疾患のモデリングに成功した。
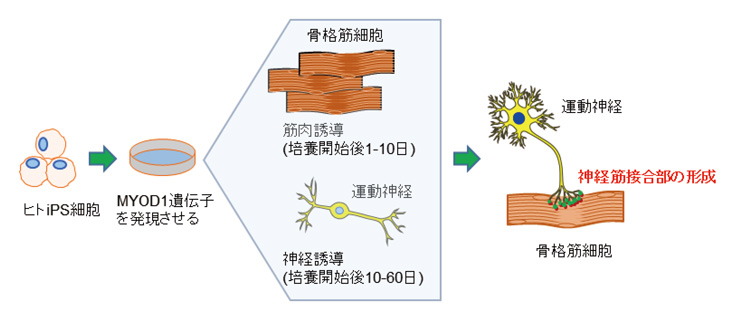
図1:ヒト神経筋接合部形成法の概要
1. 要旨
林壮宇研究員(CiRA臨床応用研究部門)、齋藤潤准教授(CiRA臨床応用研究部門)らの研究グループは、ヒトiPS幹細胞由来の機能的かつ成熟した神経筋接合部構造の構築に世界で初めて成功し、これを使って脊髄性筋萎縮症の病態モデルを構築しました。
この研究は、京都府立医科大学、台湾Academia Sinica、ソニーイメージングプロダクツ&ソリューションズ株式会社及びCiRA櫻井英俊研究室との共同研究の成果です。
この研究成果は2019 年9月19日に米国科学誌「JCI insight」にオンライン公開されました。
2. 研究の背景
神経筋接合部(Neuromuscular junction:NMJ) は運動神経終末と筋肉を電気的に連結する仕組みです。神経細胞の興奮がNMJを経て筋肉に引き継がれ、筋収縮が引き起こされることによって、私たちは体を思い通りに動かすことが出来ます。NMJを構成する細胞の異常により様々な神経筋疾患が引き起こされますが、様々な細胞からなる複雑な構造のため、ヒト生体内における解析手法は限られていました。
一方、ヒト多能性幹細胞注2)などを用いて、試験管内でヒトNMJを構築させるシステムも開発されています。研究グループは、以前にヒトiPS細胞由来運動神経細胞とマウス筋細胞の組み合わせでNMJを構成し、脊髄性筋萎縮症の病態解析に成功しています(参考:CiRA HP 研究成果 2015年3月23日「患者さん由来のiPS細胞を用いて脊髄性筋委縮症の病態を再現」)。しかし、これまでのシステムでは細胞の組み合わせが限られていたり、分化誘導系が複雑であるなどの問題がありました。また、NMJの形態も生体内のものとは大きく異なっていました。
そこで、研究グループはヒト神経筋疾患の病態解明や治療法開発に有用な、新たなヒトNMJ分化誘導系の開発を試みました。
3. 研究結果
CiRA櫻井英俊研究室は以前にヒト多能性幹細胞にMYOD1遺伝子を強制発現注3)させて骨格筋細胞を誘導する分化系を開発しています。研究グループはこの分化系を改変し、細胞培養の条件を神経細胞・筋細胞の双方に適合させることにより、ヒトNMJを簡便に誘導することに成功しました。この分化系では、従来のように、複数の細胞を別々に用意して混ぜ合わせたり、細胞を選別したりすることなく、一つの培養皿の上で培養を続けるだけでヒトNMJを作ることが出来ます。ヒトNMJは分化誘導開始20日ごろから出現し始め、当初は胎児型のNMJですが、次第に成熟し成人型へと切り替わり、100日以上維持することが出来ます。完成したNMJは、ヒトの生体内のものと類似した形態を示しました(図2)。
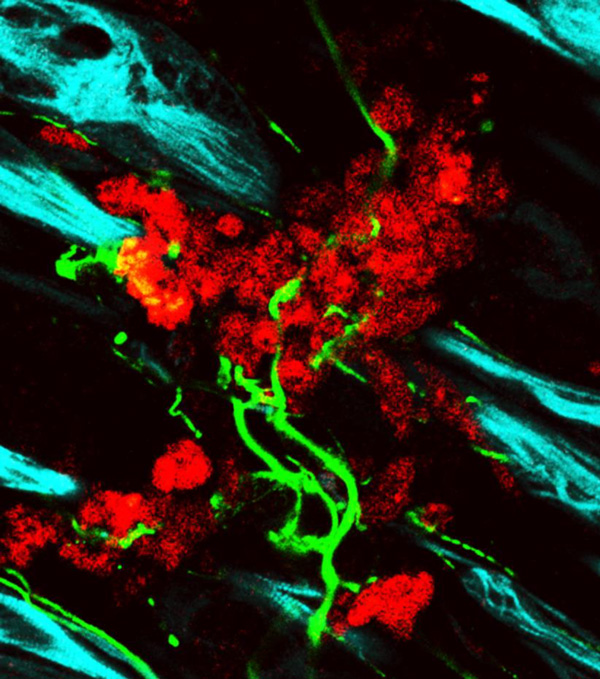
図2:ヒトNMJの免疫染色像(培養開始60日後)
赤:NMJ、水色:筋肉細胞、緑:神経細胞
また、電子顕微鏡注4)で詳細に形態を観察すると、生体内のNMJと同様に、神経細胞の末端をと筋肉細胞の結合部をSchwann細胞という細胞が覆っており、NMJ周辺にミトコンドリアが集まっている様子が観察できました(図3)。このように生体内の構造に類似したNMJを試験管内で構築することが出来たのは、世界初のことです。
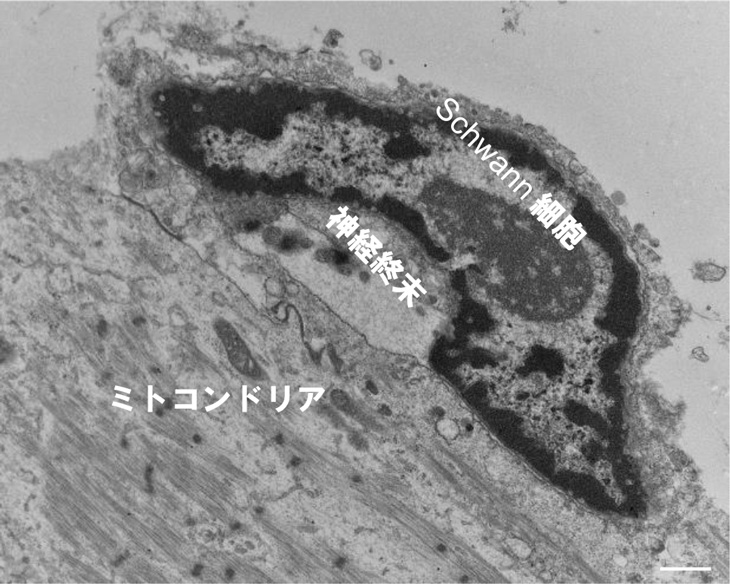
図3:ヒトNMJの走査電子顕微鏡像
NMJの機能は、神経細胞の興奮を筋肉に伝え、筋肉を収縮させることです。作製したヒトNMJがこのような機能を持っているかを調べるため、培養皿に青色レーザーを当てると神経細胞だけが興奮する仕組みを光遺伝学注5)的手法を用いて構築しました。実際に青色レーザーを当てると、筋肉の収縮が確認できました。また、筋収縮はNMJの機能を阻害する薬剤を添加することにより、完全に抑制されました。これらの結果から、今回作製したヒトNMJは培養皿の中で十分な機能を発揮し、神経細胞の興奮を筋肉に伝えることができることがわかりました。
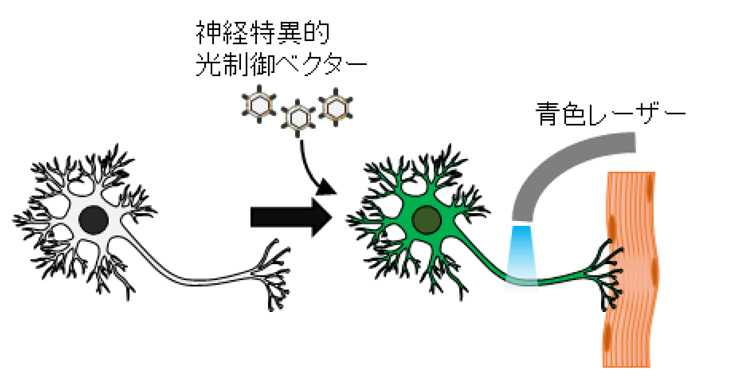
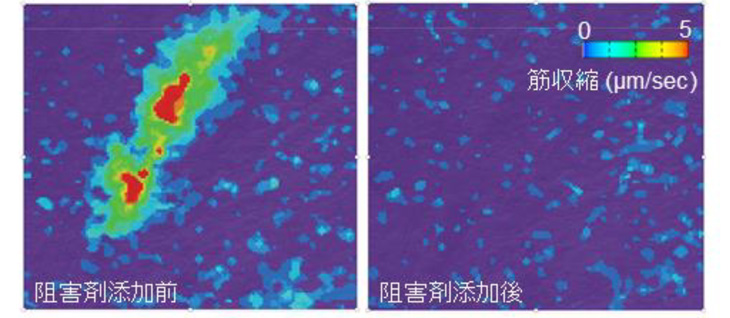
図4:(上)神経細胞の刺激システム
(下)筋肉細胞の収縮の記録。緑や赤の部分が刺激で動いている部分。
NMJの機能を阻害すると(右)、筋収縮が起こらなくなる。
最後に、作製したヒトNMJが疾患研究に使えるかを調べるため、脊髄性筋萎縮症という先天性神経筋疾患のモデルを構築しました。脊髄性筋萎縮症はSMNという遺伝子の欠損によって発症する疾患で乳児期の先天異常による死亡の第一位を占める重要な疾患です。患者さんは運動神経とNMJの機能不全により筋肉の萎縮を起こし、重症例では呼吸不全で死亡します。
健常人のiPS細胞からSMN遺伝子の働きを抑制したiPS細胞(SMNKD細胞)を作製し、この細胞からヒトNMJを作製すると、NMJの数が正常対照に比べて減少していました。また、SMNKD細胞では、神経細胞依存性の筋収縮が確認されず、NMJの機能も著しく低下していることがわかりました。以上より、脊髄性筋萎縮症患者さんでは、神経筋接合部の異常が疾患発症にかかわっていることが示唆されました。
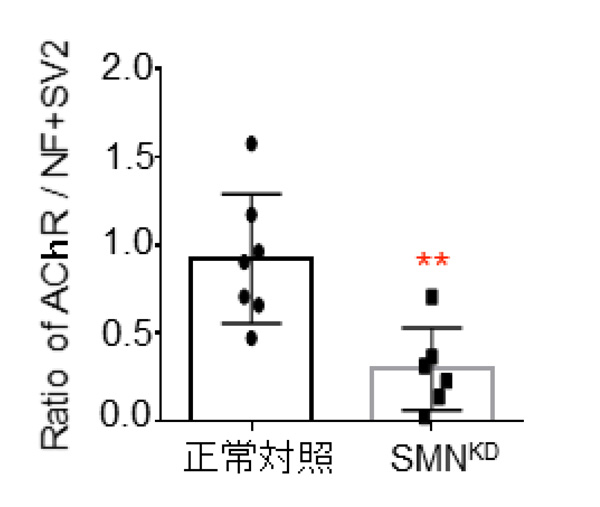
図5:SMNの機能を抑制した細胞(SMNKD)ではNMJの形成能が低下する。
4. まとめ
本研究では、ヒトiPS細胞を用い、ヒトNMJを簡便に誘導する分化系を構築することに成功しました。作製したヒトNMJは形態的、機能的に生体内のものに類似した複雑な構造を形成し、培養皿の上で成熟させることが出来ます。近年、脊髄性筋萎縮症や筋萎縮性側索硬化症などの神経筋疾患においてNMJ病変が早期に現れることが注目されており、本システムはこれらの疾患の病態解明や治療法開発に有用と考えられます。また、ヒトNMJを培養皿の上で構築することにより、ヒトNMJの形成過程の解明などの生物学的な研究にも貢献できると期待されます。
5. 論文名と著者
- 論文名
iPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases - ジャーナル名
JCI insight - 著者
Chuang-Yu Lin1, Michiko Yoshida1,2,* , Li-Tzu Li3, Akihiro Ikenaka1, Shiori Oshima4, Kazuhiro Nakagawa4, Hidetoshi Sakurai1, Eriko Matsui4, Tatsutoshi Nakahata1 and Megumu K. Saito1,*
*責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 京都府立医科大学 小児科学教室
- 台湾中央研究院Academia Sinica, Taipei, Taiwan
- ソニーイメージングプロダクツ&ソリューションズ株式会社
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金 基盤B
- AMED再生医療実現ネットワークプログラム
- iPS細胞研究基金
- 公益財団法人 持田記念医学薬学振興財団
- 公益財団法人 武田科学振興財団
7. 用語説明
注1)神経筋接合部
運動神経からの制御シグナルを骨格筋(筋線維)に伝える化学シナプスであり、略してNMJ(neuromuscular junction)と呼ばれる。運動神経から放出されるアセチルコリンと呼ばれる神経伝達物質が筋線維のアセチルコリン受容体を刺激することで骨格筋が興奮し、収縮が誘導される。
注2)多能性幹細胞
ほぼ無限に増やすことができ、体のあらゆる細胞に変化することのできる性質をもつ細胞。多能性幹細胞にはiPS細胞やES細胞がある。
注3)発現
遺伝子の情報がRNAやたんぱく質など、細胞の構造や機能にかかわる分子に変換されること。
注4)電子顕微鏡
電子線をあてて対象物を拡大し観察する顕微鏡。一般的な光学顕微鏡よりもはるかに高い倍率で観察することができる。
注5)光遺伝学
光によって細胞の機能を制御する技術の総称。光を当てることにより活性化されるたんぱく質を細胞に発現させることにより、その細胞の機能を高精度で正確に操作できる。特に神経の研究で多く用いられている。