2021-07-30 理化学研究所,帝京大学,日本医療研究開発機構
理化学研究所(理研)開拓研究本部眞貝細胞記憶研究室の山田亜夕美研究員、眞貝洋一主任研究員、帝京大学理工学部バイオサイエンス学科の平澤孝枝准教授らの共同研究グループ※は、マウスを用いて、遺伝性精神神経疾患の一つである「クリーフストラ症候群(KS)」における脳機能不全が生後でも治療できる可能性を示しました。本研究成果は、KSの治療法開発に貢献するものと期待できます。
KSは発達遅延や知能障害、自閉症様の症状が見られる、まれな遺伝性の精神神経疾患です。「エピゲノム制御[1]」に異常が起こり、遺伝子発現が正常に行われないために脳機能不全が引き起こされると考えられていますが、その分子メカニズムは不明です。
今回、共同研究グループは、KSの原因遺伝子であるヒストンメチル化酵素GLPをコードするEhmt1遺伝子をヘテロで欠損したマウスをKSのモデルマウスとして解析した結果、生後減少しているGLPの量を補充することで、活動量の低下や不安感の上昇などの行動異常が改善できることを示しました。また、Ehmt1ヘテロ欠損マウスの脳内では、ミクログリア[2]の活性化による炎症状態が引き起こされており、これがKSモデルマウスの脳内表現型の原因の一つであることも明らかにしました。
本研究は、科学雑誌『iScience』(2021年7月23日号)の掲載に先立ち、オンライン版(2021年6月17日付)に掲載されました。
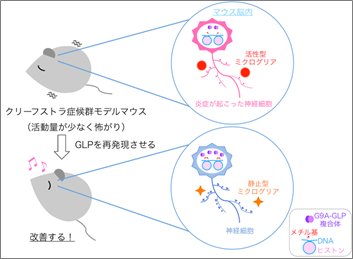
図 クリーフストラ症候群のモデルマウスにGLPを補充(再発現)すると、行動異常が改善される
※共同研究グループ
- 理化学研究所
- 開拓研究本部 眞貝細胞記憶研究室
研究員 山田 亜夕美(やまだ あゆみ)
テクニカルスタッフⅡ 西村 佳也子(にしむら かやこ)
テクニカルスタッフⅡ 志村 知古(しむら ちかこ)
基礎科学特別研究員 福田 渓(ふくだ けい)
主任研究員 眞貝 洋一(しんかい よういち) - 脳神経科学研究センター 行動遺伝学研究チーム(研究当時)
テクニカルスタッフ 向後 尚美(こうご なおみ)
チームリーダー 糸原 重美(いとはら しげよし) - 生命機能科学研究センター バイオインフォマティクス研究開発チーム
技師 林 哲太郎(はやし てつたろう)
テクニカルスタッフⅠ 梅田 茉奈(うめだ まな)
専門技術員 芳村 美佳(よしむら みか)
チームリーダー 二階堂 愛(にかいどう いとし) - 帝京大学 理工学部 バイオサイエンス学科
- 准教授 平澤 孝枝(ひらさわ たかえ)
- 東京理科大学 生命医科学研究所
- 教授 岩倉 洋一郎(いわくら よういちろう)
研究支援
本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)『エピゲノム研究に基づく診断・治療へ向けた新技術の創出』研究開発領域(研究開発総括:山本雅之)における研究開発課題「ヒストンリジンメチル化制御系に基づく脳機能の理解と治療戦略への展開(研究開発代表者:眞貝洋一、分担研究者:平澤孝枝)」、日本学術振興会(JSPS)科学研究費補助金基盤研究(A)「ヒストンH3K9メチル化修飾による転写抑制の包括的理解(研究代表者:眞貝洋一)」、同新学術領域研究(研究領域提案型)「細胞分化にともなうクロマチンポテンシャルの変化とその分子基盤(研究代表者:眞貝洋一)」、による支援を受けて行われました。
背景
クリーフストラ症候群(KS:Kleefstra Syndrome)は、まれな遺伝性の精神神経疾患の一つで、発達遅延や知能障害、自閉症様の症状が見られます。KSの原因遺伝子として、ヒストンタンパク質[3]のメチル化酵素であるGLPをコードするEHMT1遺伝子が同定されています。この遺伝子は生存に必須の遺伝子であり、細胞内に二つあるうちの一つのEHMT1遺伝子が欠失する、またはEHMT1遺伝子に変異が入ると、KSが引き起こされます。細胞内において、GLPはそのパートナーであるG9aと結合し、クロマチン上のヒストンH3の9番目のリジン残基(H3K9)をメチル化し、遺伝子の発現を調節しています。
このようなDNAの塩基配列の変化を伴わず、DNAやヒストンタンパク質のメチル化などの修飾により遺伝子発現を調節する機構を「エピゲノム制御」と呼びます。KS患者の脳内では、GLPの減少や機能低下により、エピゲノム制御に異常が起こり、遺伝子発現が正常に行われないために脳機能不全が引き起こされていると考えられていますが、その分子メカニズムは不明です。そのため、KSに対する治療は現在のところ対症療法が主であり、生後における根本的治療が可能かどうかは明らかではありませんでした。
研究手法と成果
今回、共同研究グループは、KSが生後でも治療可能か、また発症メカニズムを明らかにする目的で、KS患者と同様にEhmt1遺伝子の片側のみ(ヘテロで)を欠損させたマウス(Ehmt1ヘテロ欠損マウス:Ehmt1∆/+マウス)をKSモデルマウスとして解析しました。
まずEhmt1∆/+マウスでは、細胞内でのGLPは野生型のマウスに比べて減少しており、これに伴い脳内のH3K9メチル化にも減少が見られました(図1A)。Ehmt1∆/+マウスを用いた行動解析では、野生型マウスに比べ、オープンフィールド試験[4]では動き回る距離が短くなり、また明暗箱試験[5]では明るい場所に行く時間が短くなりました(図1B,C)。これらのことから、Ehmt1∆/+マウスには活動量の低下や不安感の上昇という行動異常の症状が見られました。
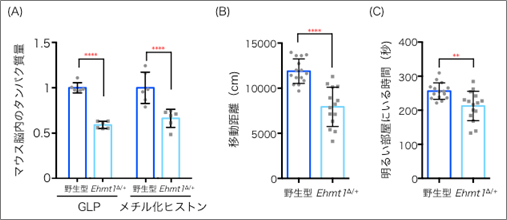
図1 Ehmt1ヘテロ欠損マウス(Ehmt1∆/+マウス)の表現型の脳内と行動解析(A)Ehmt1∆/+マウスの脳内ではGLP量が少なく、H3K9メチル化されたヒストンの量も減少していた。
(B)オープンフィールド試験で、Ehmt1∆/+マウスは移動距離が短かった。
(C)明暗箱試験において、Ehmt1∆/+マウスは明るい部屋の滞在時間が短かった。
そこで、Ehmt1∆/+マウスに、生後、薬剤投与により外来性のGLPを発現できるような遺伝子組換えを行い、GLPの量を補充することで、行動異常が改善されるか調べました。
まず、脳内にある神経細胞と神経細胞を補佐する役割のグリア細胞[2]の両方でGLPの量を補充できるように、体の全細胞において外来性GLP発現を試みました。ヒトの幼少期に当たる生後3週齢で薬剤投与を行い、投与後約1カ月の8週齢で行動解析を行いました。しかし、活動量の低下も不安感の上昇もEhmt1∆/+マウスと同様で、行動異常に改善は見られませんでした(図2)。投与後1カ月では回復が不十分な可能性もあったことから、さらに2カ月待ち、16週齢で再び行動解析を行いました。すると、完全ではないものの、活動量と不安感の両方で改善傾向が見られました(図2)。このことから、KSモデルマウスでは、GLPの補充により、生後でも行動異常が改善可能であること、ただし症状の改善には時間を要することが明らかになりました。
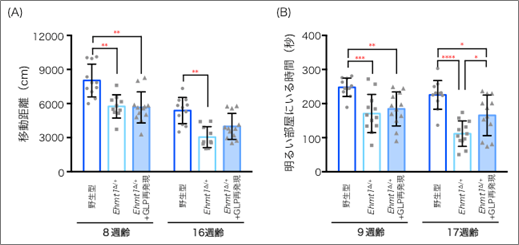
図2 GLPの補充(再発現)によるEhmt1∆/+マウスの表現型への効果(A)オープンフィールド試験において、GLP再発現後1カ月(8週齢)では移動距離はEhmt1∆/+マウスと変わらなかったが、さらに2カ月後の16週齢では改善が見られた。
(B)明暗箱試験において、GLP再発現後1カ月(9週齢)では明るい部屋にいる時間はEhmt1∆/+マウスと変わらなかったが、さらに2カ月後の17週齢では改善が見られた。
さらに、行動異常の回復に必要な細胞を同定する目的で、神経細胞のみGLPを補充する実験を行いました。前の実験と同様に、3週齢でGLPを発現誘導させ、8週齢と16週齢で行動解析を行いましたが、どちらの週齢においても行動異常の改善は見られませんでした。この結果から、行動異常の改善には、神経細胞と非神経細胞の両方でGLPを補充する必要があることが分かりました。
神経細胞は、枝状の軸索や樹状突起を伸ばし、周りの神経細胞の軸索上にあるとげ様のスパイン[6]とシナプス[6]を介して情報を伝達し、神経回路を構築しています。脳の発達過程や外からの刺激に応じて、ミクログリアが不必要なスパインを除去することで、神経回路の構築や再編成が行われています。これまで他のグループから、Ehmt1∆/+マウスの海馬の神経ではスパイン数が減少していると報告されています。そこでEhmt1∆/+マウスの大脳皮質の神経を解析したところ、野生型マウスに比べてスパイン数が減少していることが分かりました(図3)。また、スパインの増減に関わるミクログリアに違いがないか調べたところ、Ehmt1∆/+マウスではミクログリアの数が増加し、その中でも貪食能[7]が高まった活性型のミクログリアが増えていることが分かりました(図3)。
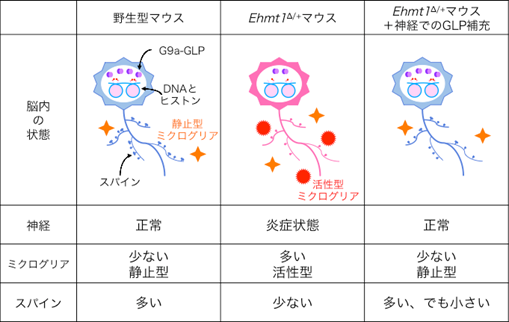
図3 Ehmt1∆/+マウスの脳内の状態と神経でのGLP補充の効果Ehmt1∆/+マウスの脳内では、活性型ミクログリアにより神経が炎症状態にあり、スパインの数も少ない。そのEhmt1∆/+マウスのGLPを補充すると、活性型ミクログリアが少なくなり、神経の炎症状態は正常に戻った。ただしスパインに関しては、数は増えたものの形が小さく未熟であった。
通常、ミクログリアの活性化は炎症により引き起こされることから、Ehmt1∆/+マウスの脳内が炎症状態にある可能性が考えられました。そこで、炎症関連遺伝子の発現を調べたところ、Ehmt1∆/+マウスではCasp1、Il1bなどの炎症関連遺伝子の発現が上昇していることが分かりました。一方、上述の神経細胞のみGLPを補充し、行動異常が改善されなかったEhmt1∆/+マウスでは、エピゲノム制御不全は回復し、炎症関連遺伝子の発現が抑制され、ミクログリアの増加や活性化も抑圧されており、それに伴い減少していたスパイン数も回復していることが分かりました。ただしスパイン数は増加していたものの、形が小さく未成熟であったために、神経回路の再構築までには至らず、行動異常が回復されなかったのだと考えられます(図3)。
このことから、Ehmt1∆/+マウスの脳内ではエピゲノム制御不全により炎症が引き起こされ、それがミクログリアを活性化させることで、スパイン数を減らし、最終的にKS様の症状を引き起こしている可能性が示されました。
上述したKSモデルマウスで見られる脳内の症状と炎症の関係をさらに解析するため、Ehmt1∆/+マウスで発現上昇が見られた炎症関連遺伝子のIl1bを欠損したマウス(Il1b∆/∆)とEhmt1∆/+マウスとを交配させ、二重変異マウスを作製しました。この二重変異マウスを解析した結果、Il1b遺伝子の欠損は、Ehmt1ヘテロ欠損マウスに対して神経特異的にGLP補充と同じ効果があることが分かりました。
以上の結果から、Ehmt1ヘテロ欠損で誘導される行動異常は、(1)生後でもGLPの補充により改善できること、(2)その改善には神経細胞と非神経細胞の両方でGLPの補充が必要なこと、(3)KS様症状の発症の原因の一つに炎症が関与していることが明らかになりました。
今後の期待
今回の研究はあくまでKSモデルマウスにおいて遺伝子組換えを用いた結果であり、KSの治療にすぐに適応されるものではありません。しかしながら、KS患者にとって、脳機能不全が生後でも改善できる可能性を示したことには大きな意味があるといえます。もしKS患者脳内でも、今回モデルマウスで見られたような病態が起きていることが分かれば、炎症を抑えることは新たな治療戦略の一つになるかもしれず、今後の研究が待たれます。
論文情報
- タイトル
- Derepression of inflammation-related genes link to microglia activation and neural maturation defect in a mouse model of Kleefstra Syndrome
- 著者名
- Ayumi Yamada, Takae Hirasawa, Kayako Nishimura, Chikako Shimura, Naomi Kogo, Kei Fukuda, Madoka Kato, Masaki Yokomori, Tetsutaro Hayashi, Mana Umeda, Mika Yoshimura, Yoichiro Iwakura, Itoshi Nikaido, Shigeyoshi Itohara, Yoichi Shinkai
- 雑誌
- iScience
- DOI
- 10.1016/j.isci.2021.102741
補足説明
- [1]エピゲノム制御
- DNAの塩基配列の変化を伴わず、DNAやヒストンのメチル化、アセチル化、リン酸化などの化学修飾により遺伝子発現を調節する機構。この修飾は細胞分裂を超えて維持され、世代を超えて子孫にまで受け継がれるものもある。
- [2]ミクログリア、グリア細胞
- グリア細胞とは、神経系の中で、神経細胞以外の細胞の総称であり、神経を補佐する役割を担っている。中枢神経系では、アストロサイト、オリゴデンドロサイト、ミクログリア細胞が含まれる。中でもミクログリア細胞は、他のグリア細胞とは異なり末梢の造血幹細胞由来であり、脳内での免疫防御を担当している。脳内に侵入した細菌や死細胞などを貪食(後述)し、脳内の恒常性維持に働いている。
- [3]ヒストンタンパク質
- 真核生物の染色体を構成する塩基性タンパク質で、H1、H2A、H2B、H3、H4の5種類ある。その中のH2A、H2B、H3、H4が各2分子集まり8量体を形成し、その周りにDNAが巻き付くことで、DNAを核内にコンパクトに収納している。
- [4]オープンフィールド試験
- 行動解析試験の一つで、マウスの自発的活動能を解析するテスト。マウスを大きさ50cm程度の明るい箱に入れ、そこで一定時間自由に探索させる。移動距離や、新立ち上がり回数、中央部位での滞在時間等を計測し、新奇環境での自発的活動性や不安様行動を評価する。
- [5]明暗箱試験
- 行動解析試験の一つで、マウスの不安様行動を解析するテスト。明るい箱と暗い箱の間のしきりにマウスが通り抜けられる穴をあけた箱を用いる。マウスは暗所を好むことから、明箱に出てくるまでの時間や、明箱での滞在時間、二つの箱を往来する回数等で不安感を評価する。
- [6]スパイン、シナプス
- 脳の神経細胞から長い軸索と枝上の樹状突起が伸びており、この突起が他の神経細胞とつながり神経回路を構築している。この神経細胞の接続部をシナプスと呼び、その受け手側となる樹上突起上のとげ様の構造体をスパインという。シナプス前部から放出された神経伝達物質をスパイン上の受容体が受けることで、電気信号を伝えていく。
- [7]貪食能
- 細胞が、死細胞や、細菌、細胞からの分泌物や老廃物を取り込み、分解、除去する作用のこと。脳内ではミクログリアがこの役割を担っている。
発表者・機関窓口
発表者
理化学研究所 開拓研究本部 眞貝細胞記憶研究室
研究員 山田 亜夕美(やまだ あゆみ)
主任研究員 眞貝 洋一(しんかい よういち)
帝京大学 理工学部 バイオサイエンス学科
准教授 平澤 孝枝(ひらさわ たかえ)
機関窓口
理化学研究所 広報室 報道担当
帝京大学 本部広報課
AMED事業について
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課