2024-05-17 東京大学
研究成果のポイント
- 胚中心※1におけるB細胞選択のメカニズムについて、B細胞受容体※2からのシグナルの役割を解明
- 胚中心は細菌・ウイルスなどの感染により形成される構造体で、免疫応答を行うB細胞を増殖させて抗体の性能を高める機能を持っているが、B細胞選択や増殖のメカニズムは不明な点が多い
- 胚中心B細胞受容体シグナルを過剰に亢進させると、活性酸素種※3の発生による細胞死を導くことを解明
- Cskチロシンキナーゼ※4は、胚中心B細胞受容体シグナル制御に重要な役割を担っており、抗体の親和性成熟※5に必須であることを解明
- より効果的な抗体を産生するための新しいワクチンデザインへ期待
概要
B細胞は液性免疫(抗体を中心とした免疫反応)において必須の細胞ですが、どのように増殖するかについては、未解明な部分があります。大阪大学免疫学フロンティア研究センター 井上毅 招へい教授(東京大学国際高等研究所新世代感染症センター 教授)、大阪大学微生物病研究所の岡田雅人教授(研究当時、現:大阪大学ワクチン開発拠点先端モダリティ・ドラッグデリバリーシステム研究センター 特任教授(常勤))、大阪大学免疫学フロンティア研究センター 黒﨑知博 招へい教授(理化学研究所生命医科学研究センター チームリーダー)らの研究グループは、B細胞の親和性成熟の場である胚中心で、B細胞が適切に選択され、抗体の親和性成熟を導くメカニズムを明らかにしました。
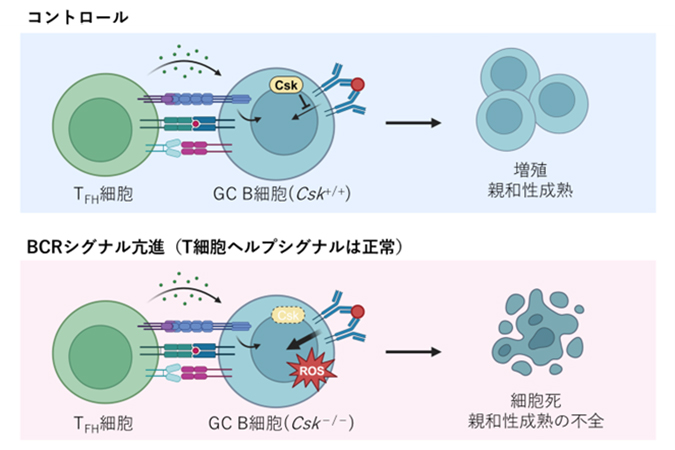
B細胞、T細胞といったリンパ球は、細菌・ウイルスなどの微生物感染において、生体防御反応の中心的役割を担います。ウイルス、ワクチンなどの外来抗原が体内に入ると、脾臓やリンパ節などの2次リンパ組織の中で胚中心と呼ばれる構造体が形成されます。胚中心では、B細胞が盛んに増殖し、将来産生する抗体の性能を高める親和性成熟という現象が起こります。この胚中心において、どのようなB細胞が選択され、増殖していくかのメカニズムは、不明な点が多く残されていました。本研究では、胚中心B細胞の運命を決定する重要な2つのシグナル(B細胞受容体シグナルとヘルパーT細胞からのシグナル)に着目し、B細胞受容体シグナルのみが亢進するマウスモデルを開発して解析を行いました。その結果、B細胞受容体シグナルの過剰な亢進は活性酸素種の産生による細胞死を誘導し、親和性成熟が適切に起こらなくなることが分かりました(図1)。本研究成果は、胚中心B細胞選択のメカニズム解析という基礎研究のみならず、抗原に対してより効果的な抗体を産生するための新しいワクチンデザインに貢献することが期待されます。
この成果は、米国の科学誌Journal of Experimental Medicine (オンライン)に2024年 5月 17日(日本時間)に掲載されました。
研究の背景
新型コロナウイルスやインフルエンザウイルスなどによる感染症に対する生体防御メカニズムの解明は社会的にも重要かつ喫緊の課題です。B細胞と抗体は、細菌・ウイルスなどに対する液性免疫応答の中心的役割を担っています。抗原の侵入に応じて2次リンパ組織につくられる胚中心では、B細胞が盛んに増殖し、将来産生する抗体の性能を高める親和性成熟が起こります。この胚中心B細胞は、B細胞受容体シグナルとヘルパーT細胞からのシグナルの強さに応じて適切に選択され、増殖していきますが、これらのシグナルがどのような役割を果たしているか、その詳しい仕組みは不明な点が多く残されていました。本研究グループは、B細胞受容体シグナルの役割の解明を目的として、新しいマウスモデルを開発して解析を行いました。
本研究の成果
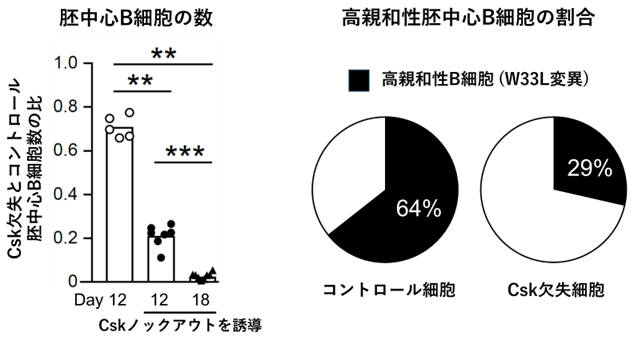
研究グループは、CskチロシンキナーゼというB細胞受容体シグナルを負に制御するタンパク質に着目し、B細胞受容体シグナルを亢進させることを目的として胚中心B細胞特異的Csk欠失マウスを開発しました。このマウスでは、想定通り胚中心B細胞においてB細胞受容体シグナルが亢進している一方、ヘルパーT細胞からのシグナルは正常のままであることが分かりました。意外なことに、B細胞受容体シグナルのみが亢進したCsk欠失胚中心B細胞には細胞死が誘導され、結果的に親和性成熟が正常に誘導されないことが分かりました(図2)。さらに詳細な解析により、Csk欠失胚中心B細胞では、エネルギー産生の場であるミトコンドリアにおける活性酸素(ROS)の発生が上昇しており、これが細胞死を誘導する原因の一つであることが分かりました。
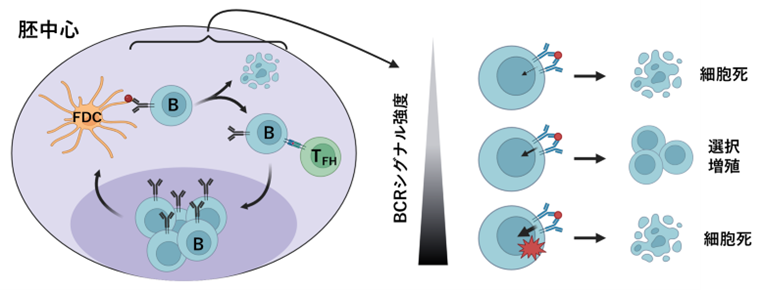
一方、本研究グループはこれまでの研究で九州大学馬場義裕教授らとの共同研究により、B細胞受容体下流のカルシウムシグナルの減弱は抗原への親和性を低下させることを報告していました(Yada et al., J Exp Med, 2024 (doi:10.1084/jem.20222178))。これら一連の研究成果を統合すると、正常な胚中心B細胞の選択と親和性成熟を誘導するためには、適切な範囲のB細胞受容体シグナル強度が必要であることが示唆されました(図3)。
本研究成果が社会に与える影響(本研究成果の意義)
新型コロナウイルスやインフルエンザウイルスなどが引き起こす感染症において、胚中心B細胞が抗体遺伝子に変異を蓄積させ、適切な抗原親和性を持つ抗体を発現する能力を記憶B細胞として保持していくことが、変異ウイルスに対する生体防御能を発揮するために重要であることが分かってきました。胚中心B細胞反応の仕組みは非常に精緻で複雑であり、完全に明らかになっていませんが、本研究による胚中心B細胞選択メカニズムの解析は、抗原に対するB細胞受容体シグナルの役割の一端を明らかにしたものであり、将来的に感染防御により有効なワクチン開発につながる可能性があります。
[用語解説]
※1 胚中心
免疫応答時にリンパ節や脾臓などの2次免疫組織につくられる微小構造。ここでは、B細胞が増殖するとともに抗体遺伝子に変異を入れて、より良い抗体を産生できるようにする。
※2 B細胞受容体
B cell receptor; BCR。B細胞表面に発現する膜型の免疫グロブリンタンパク質で、抗原に結合すると細胞内にシグナルを伝え、B細胞の活性化・分化を引き起こす。それぞれのB細胞は異なる配列のB細胞受容体を発現しており、異なる抗原を認識することができる。胚中心ではB細胞受容体遺伝子に変異が入り、抗原親和性が変化する。
※3 活性酸素種
reactive oxygen species; ROS。主にミトコンドリアでの代謝過程において産生され、細胞死を含むさまざまな細胞応答を誘導するシグナル伝達物質。
※4 Cskチロシンキナーゼ
C-terminal Src kinase。細胞増殖、形態変化、運動制御など様々な細胞内シグナル伝達に関わるSrc型チロシンキナーゼをリン酸化することで活性を抑制的に制御するタンパク質。B細胞ではB細胞受容体下流ではたらき、B細胞受容体シグナルを抑制している。
※5 親和性成熟
B細胞が免疫応答の過程で抗原に対する親和性を高めていく現象。胚中心においてB細胞受容体遺伝子に変異が入り、その中から適切なB細胞が選択されるというサイクルを繰り返すことで起こる。
[著者]
Takeshi Inoue1,2,*, Yuma Matsumoto3, Chie Kawai1, Mao Ito3, Shigeyuki Nada3, Masato Okada3,4, and Tomohiro Kurosaki1,4,5,* (*責任著者)
[所属]
1大阪大学免疫学フロンティア研究センター(WPI-IFReC) 分化制御研究室
2東京大学国際高等研究所新世代感染症センター(UTOPIA) 分子免疫システム分野
3大阪大学微生物病研究所 発癌制御研究分野
4大阪大学感染症総合教育研究拠点(CiDER)
5理化学研究所生命医科学研究センター 分化制御研究チーム
本研究は、日本学術振興会科学研究費助成事業、日本医療研究開発機構(AMED)先進的研究開発戦略センター(SCARDA)「ワクチン開発のための世界トップレベル研究開発拠点の形成事業」(ワクチン開発のための世界トップレベル研究開発拠点群 東京フラッグシップキャンパス)、先進医薬研究振興財団、持田記念医学薬学振興財団、武田科学振興財団、内藤記念科学振興財団、住友財団の支援を受けて行われました。
論文情報
Takeshi Inoue*, Yuma Matsumoto, Chie Kawai, Mao Ito, Shigeyuki Nada, Masato Okada, and Tomohiro Kurosaki* , “Csk restrains BCR-mediated ROS production and contributes to germinal center selection and affinity maturation,” Journal of Experimental Medicine: 2024年5月17日, doi:10.1084/jem.20231996.
論文へのリンク (掲載誌)
お問い合わせ先
<研究に関すること>
井上 毅 (いのうえ たけし)
東京大学国際高等研究所新世代感染症センター 分子免疫システム分野 教授
大阪大学免疫学フロンティア研究センター 招へい教授
黒﨑 知博 (くろさき ともひろ)
大阪大学免疫学フロンティア研究センター 招へい教授
理化学研究所 生命医科学研究センター 分化制御研究チーム チームリーダー