2024-06-13 東京大学定量生命科学研究所
発表概要
発表のポイント
- 自閉スペクトラム症(以下、自閉症)の「友人を記憶する能力の低下」という症状は、脳のどの領域の機能が変化したことに起因するかはわかっていなかった。
- 他者についての記憶(社会性記憶)を貯蔵する海馬の腹側CA1領域の神経細胞において、自閉症関連遺伝子Shank3が働かなくなると、「友人を記憶する能力の低下」という自閉症の症状が現れた。本研究により、自閉症の病態に海馬が関与することが明らかになった。
- 自閉症における神経発達障害の神経メカニズムの理解が進むと共に、海馬腹側CA1領域が自閉症の新規治療法開発における標的領域となる可能性が期待される。
概要
東京大学定量生命科学研究所の奥山輝大准教授、同大学大学院医学系研究科ジョンミョン大学院生(研究当時)らのグループは、自閉症における「友人を記憶する能力の低下」という症状が、海馬の腹側CA1領域(注1)の異常に起因することを発見しました。
私たちは日々の生活の中で、友人ひとりひとりを記憶することができますが、自閉症の方はその能力が一部低下していることが知られています。マウスを用いた本研究では、他者についての記憶を貯蔵している「海馬腹側CA1領域」に注目し、自閉症関連遺伝子のShank3遺伝子の働きをin vivoゲノム編集技術(CRISPR/Cas9法)(注2)により機能欠損させたところ、「友人を記憶する能力の低下」という症状を模倣することに成功しました(図1)。
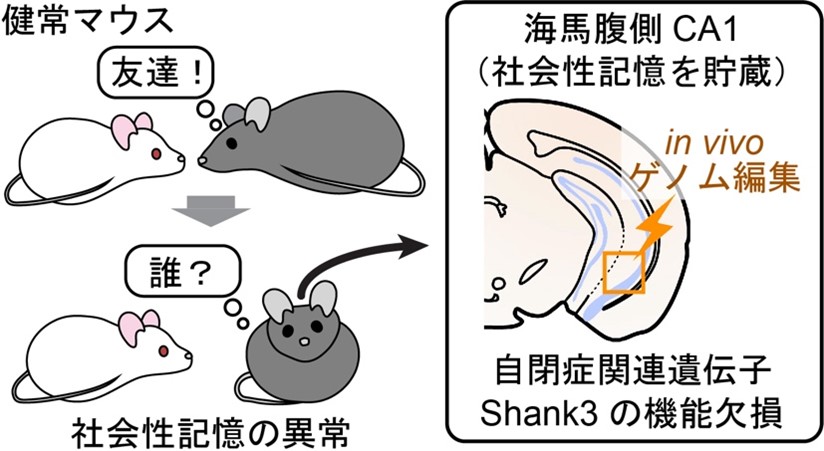
図1:in vivoゲノム編集技術による遺伝子操作
海馬腹側CA1領域でのみ自閉症関連遺伝子の機能を欠損させたところ、社会性記憶に異常が生じた
自閉症の病態神経メカニズムの理解が進むと共に、いまだ創薬が進んでいない自閉症の新規治療法開発において、海馬腹側CA1領域が創薬標的領域となる可能性が期待されます。
本研究成果は、2024年6月12日に英国科学誌「Nature Communications」のオンライン版に掲載されました。
発表内容
【研究の背景】
他者についての記憶、すなわち社会性記憶は、ヒトを含む多くの社会を作る動物にとって、生存のために必須な能力です。一方、自閉症患者の多くが社会性記憶に困難を抱えていることが臨床研究により報告されており、自閉症関連遺伝子に変異を持つ自閉症モデル動物も同様に社会性記憶に異常を示すことが知られています。
本研究グループではこれまで、記憶中枢である海馬の腹側CA1領域の神経細胞に「誰」という他者への記憶が貯蔵されており、複数の神経細胞の「組み合わせ」で特定の相手についての記憶を保持していることを示してきました(図2)(Okuyama et al., Science 2016)。

図2:海馬腹側CA1領域では、複数の神経細胞の「組み合わせ」で特定の相手の記憶を保持する
また、自閉症関連遺伝子のShank3に欠損を持つマウス(Shank3ノックアウトマウス)は、社会性記憶が低下しており、特定の相手の記憶を保持する海馬の神経細胞集団の神経活動にも異常が生じていることを見出してきました(Tao et al., Molecular Psychiatry 2022)。
しかし、このShank3ノックアウトマウスにおける社会性記憶異常が、海馬腹側CA1領域の神経細胞の異常に起因するものかという「因果関係」は不明でした。
【研究内容】
本研究では、アデノ随伴ウイルス(AAV)、あるいは、特殊な細胞外小胞(注3)を介したin vivoゲノム編集技術(CRISPR/Cas9法)を用いて、海馬腹側CA1領域でのみShank3遺伝子特異的に変異を誘導し、機能欠損させました。
健常マウスは通常、見知った個体と見知らぬ個体を識別し、見知らぬ個体により長い時間接近をするという生得的な性質を持っています。この性質を利用し、テストマウスが見知った個体と見知らぬ個体に接近した時間を測ることで、どの程度、相手の個体を記憶していたかを定量することができます(社会性識別テスト)。この社会性識別テストで行動試験を行ったところ、海馬腹側CA1領域においてShank3遺伝子の機能を欠損させたマウスは、社会性記憶に異常を示すことがわかりました。
さらに、細胞外小胞を用いたゲノム編集技術は、CRISPR/Cas9タンパク質そのものを標的領域に送達するため、小胞濃度を希釈することにより段階的に標的遺伝子を編集する細胞数を制御できることに注目しました。段階的にShank3遺伝子を欠損させた海馬腹側CA1細胞を増やしていくと、「ある閾値を超えた」時に社会性記憶に異常が生じることが示唆されました(図3)。
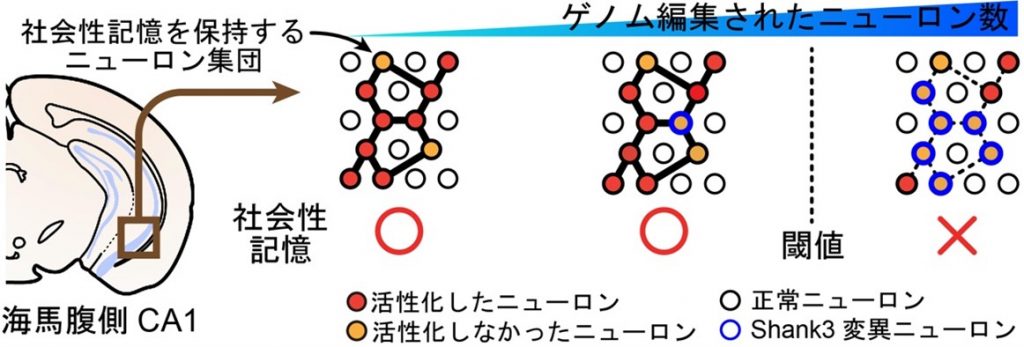
図3:海馬腹側CA1におけるShank3遺伝子の機能欠損
ある閾値以上の数の海馬腹側CA1領域の神経細胞でShank3遺伝子が欠損すると、社会性記憶に異常が生じた
【今後の展望】
2024年現在、人口のおよそ2-3%は自閉症と診断されています。本研究により、自閉症の社会性記憶異常という病態神経メカニズムの一端が明らかになり、臨床分野においても新規治療法の開発に寄与することが期待されます。
〇関連情報:
「プレスリリース①他人を記憶するための海馬の仕組み」(2016/9/30)
- https://www.riken.jp/press/2016/20160930_1/(外部リンク: 理化学研究所)
「プレスリリース②「友達」を記憶する、海馬の神経活動パターン」(2022/2/4)
研究助成
本研究は、科学技術振興機構(JST)「創発的研究支援事業(課題番号:JPMJFR2143)」「さきがけ(課題番号:JPMJPR1781)」「CREST(課題番号:JPMJCR23B1)」、日本学術振興会(JSPS)「科学研究費助成事業(課題番号:JP18H02544,JP20K21459,JP21H02593, JP21H05140)」「特別研究員奨励費(課題番号:JP22J11822,JP22J21085,JP20J01468,JP19J00911)」、日本医療研究開発機構(AMED)「脳とこころの研究推進プログラム(課題番号:JP21wm0525018)」、内藤記念科学振興財団、セコム科学技術振興財団の支援により実施されました。
用語解説
※注1:海馬腹側CA1領域
記憶の中枢として知られている海馬は、背側と腹側で機能が分かれていることが知られています。その中でも、海馬の背側CA1領域のニューロンは「空間」や「時間」の情報が貯蔵されていることがわかっており、本研究グループは腹側CA1領域のニューロンが「誰」という他者についての記憶を貯蔵していることを発見しました。
※注2 in vivoゲノム編集技術(CRISPR/Cas9法)
標的ゲノム配列のDNAの二本鎖を切断する、遺伝子改変ツールです。CRISPR/Cas9はDNAを切る「Cas9ヌクレアーゼ」と標的ゲノム配列を認識する「ガイドRNA」で構成されます。切断されたDNAはしばしば正確に修復できないことを利用し、標的遺伝子に対して変異を誘導することができます。さらに近年では、このCRISPR/Cas9分子を直接送達することで、ゲノム編集を生体内で行わせるin vivoゲノム編集技術に注目が集まっています。基礎研究のみならず遺伝子疾患に対する臨床応用にも期待が集まっており、本技術の発見に対して2020年にノーベル化学賞が贈られました。
※注3 細胞外小胞
細胞外小胞は、細胞が分泌する脂質膜小胞で、その中にはさまざまな核酸、脂質、タンパク質などが内包されています。細胞はこの分子を他の細胞に運ぶことによって、細胞間コミュニケーションを行っていることが知られています。近年、細胞外小胞の中に治療のための分子を内包させることで、バイオ医薬品への応用可能性に期待が高まっています。本研究では、細胞外小胞にCRISPR/Cas9法のための分子を内包させ、標的脳領域に入れることにより、脳領域特異的な変異誘導を行いました(図4)。
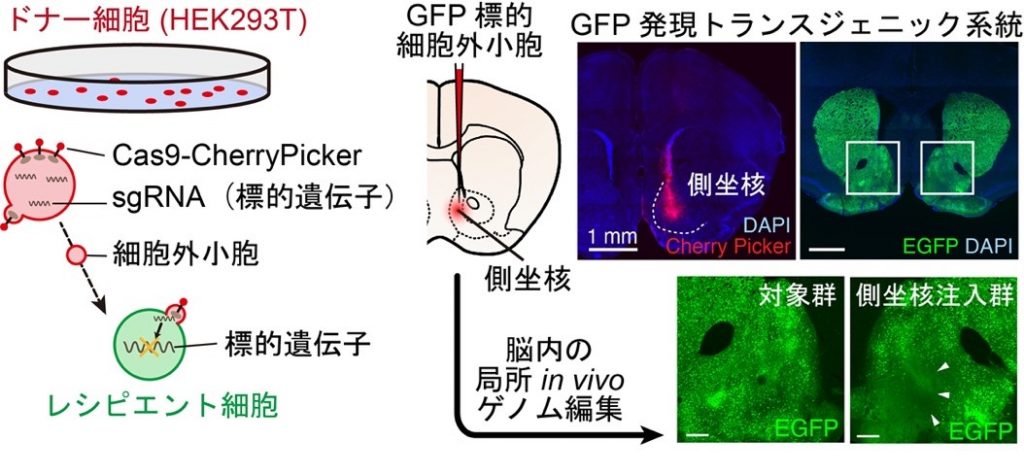
図4:細胞外小胞を利用したゲノム編集技術
標的遺伝子に変異を挿入できるよう設計した細胞外小胞を、脳内の特定の場所に顕微注入することで、局所的なin vivoゲノム編集が可能となった
雑誌名等
雑誌名:Nature Communications
題 名:Conditional knockout of Shank3 in the ventral CA1 by quantitative in vivo genome-editing impairs social memory in mice
著者名:Myung Chung, Katsutoshi Imanaka, Ziyan Huang, Akiyuki Watarai, Mu-Yun Wang, Kentaro Tao, Hirotaka Ejima, Tomomi Aida, Guoping Feng, Teruhiro Okuyama*
DOI: 10.1038/s41467-024-48430-x
URL: https://www.nature.com/articles/s41467-024-48430-x
掲載日時:日本時間 2024 年6月12日18時