2024-06-14 東京工業大学
要点
- 従来法では構造決定が困難な天然変性タンパク質の構造決定に成功。
- 無細胞タンパク質結晶化により、従来より10万分の1のスケールと10分の1の時間で大規模な迅速構造決定に成功。
- がんなどのタンパク質―タンパク質相互作用が関与する疾患に向けた創薬開発に期待。
概要
東京工業大学 生命理工学院 生命理工学系の小島摩利子大学院生(現 北海道大学博士研究員)と安部聡助教(現 京都府立大学准教授)、古田忠臣助教、上野隆史教授(兼 東工大 科学技術創成研究院 自律システム材料学研究センター)のグループは理化学研究所 放射光科学研究センター 平田邦生専任技師の研究グループと共同で、無細胞タンパク質結晶化(CFPC)法[用語1]を用いて、天然変性タンパク質(IDP)[用語2]を細胞内で自発的に結晶化するタンパク質結晶である多角体[用語3]に固定化し、「組木細工」のように結晶化することで構造決定する技術を開発した。
IDPは外部環境に応答して動的に構造変化するタンパク質であり、がんなどのさまざまな疾患において重要な役割を果たしていることが知られている。IDPの構造を理解すれば、多くの疾患を克服する創薬が可能となる。しかし、高い柔軟性を有するIDPは一般的な手法による構造決定がいまだに困難であり、その解決策が求められていた。
本研究では、CFPC法により結晶化する安定な足場タンパク質である「多角体」の最も適切な領域にIDPで重要とされる配列を融合することにより、その構造決定に成功した。本研究のポイントは、従来の結晶化手法に対して、実験スケールの縮小(3 Lから30 µLへ)・短時間化(3ヵ月から3日以内へ)に同時に成功した点である。さらに、分子設計を迅速化するため、Web公開されているアプリケーションを用いた構造解析システムを確立した。本システムを活用し、天然の複合体形成によりαヘリックス構造を保持するIDPであるc-Myc[用語4]の重要領域を多角体に融合し、人工的に設計した相互作用により天然と同様のαヘリックス構造を形成させることに成功した。この成果は、「これまで決定できなかったタンパク質構造を基にした薬剤デザイン」や「ハイスループット性を活用したビッグデータ構築による創薬基盤」へ貢献すると期待される。
本成果は、自然科学分野において最も権威のある学術誌の一つである「Proceedings of National Academy of Sciences of United States of America(米国科学アカデミー紀要)」のオンライン版で6月11日(現地時間)に公開された。
背景
天然変性タンパク質(IDP)は外部環境に応答し、多様な機能を発揮するタンパク質であり、結合パートナーの分子構造を反映した立体構造変化を示す。IDPの構造を安定化する決定因子を原子レベルで同定することは、IDPの生物学的機能を理解するために重要である。しかし、IDPは柔軟性が高く構造決定が困難であり、構造変化のルールを把握するための十分な構造情報はこれまで蓄積されてこなかった。そこで、研究グループは、IDPのように難易度の高いターゲット分子の構造解析を達成するため、高品質タンパク質結晶のモノマーの一部をターゲット分子に置換した変異体を「組木細工」のように結晶化することで、IDPの重要領域の構造決定を試みた(図1)。当研究グループは、ターゲット分子の足場として高品質ながら迅速かつ小規模な合成が可能な細胞内タンパク質結晶に着目し、これまでに昆虫細胞内で結晶化する細胞内タンパク質結晶「多角体」に固定化した10残基タンパク質CLN025の構造決定に成功している[参考文献1]。さらに、新しい結晶化手法として、無細胞タンパク質発現を用いた迅速なタンパク質結晶化方法を開発し、これを「無細胞タンパク質結晶化(CFPC)法」と名付けた[参考文献2]。CFPC法は、数か月の結晶化スクリーニングを要する従来のin vitro結晶化を劇的に効率化するため、IDPのような難易度の高いターゲット分子の構造決定を実現する結晶設計の最適化スクリーニングへの適用が期待される。
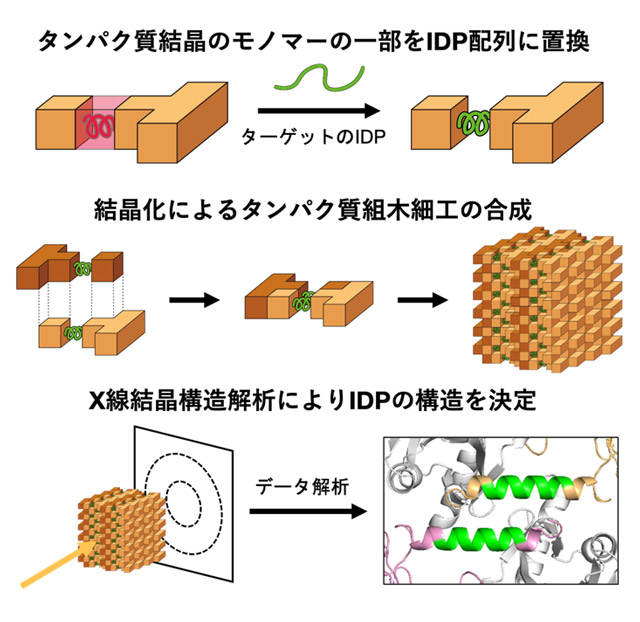
図1. タンパク質結晶を「組木細工」の足場に用いた構造解析の手順
研究成果
本研究では、「タンパク質組木細工」を用いたIDPの構造解析にCFPC法を取り入れたスクリーニングを導入し、がん治療薬の標的IDPであるc-Mycの構造決定を行なった(図2上)。c-Mycはパートナータンパク質であるMAXと結合してがんを進行させる可能性があり、c-MycとMAXの結合を阻害する分子ががん治療薬の候補となることから、c-Mycの原子レベルの構造情報は重要である。
まず、昆虫細胞内で自律的に結晶を形成する「多角体」を足場結晶とし、モノマーのF12–N29とE70–Y83中の11残基をc-MycのY402–K412(11残基)に置換した、12通りの変異体を設計した(図2下)。これらの変異体モデルをシミュレーションソフトFolditで作成し、算出された自由エネルギーが最も低く安定な分子構造が期待される6種類の変異体を選定した後、CFPC法で合成を試みた。その結果、72時間、30 µLの反応スケールの結晶化反応で5 µmサイズの結晶が得られた。
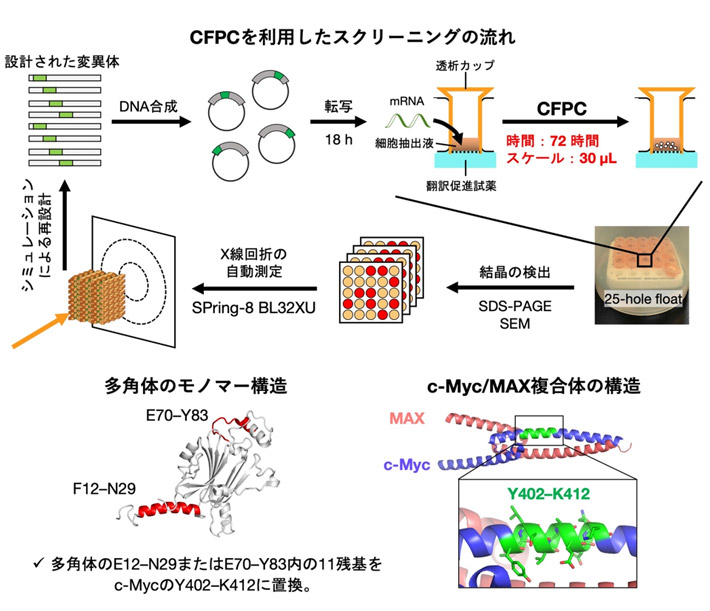
図2. 多角体のCFPCスクリーニングを活用したc-Mycの構造決定
多角体を足場として固定化したc-MycのX線回折測定を行ったところ、1個の変異体(c-Myc_1/PhCΔ15–25)で1.92 Åの分解能でc-Mycの構造決定に成功した(図3)。
結晶構造解析の結果、多角体内でのc-Mycは、MAXと複合体をつくる際と同様にαヘリックス構造を形成していることが分かった。c-Mycの構造は5本の疎水性相互作用と2本の水素結合により安定化されており、これらの分子間相互作用がc-Mycのヘリックス構造の固定に重要な因子の候補として絞られた。c-Mycのヘリックスを維持する要因とこれらの結合の重要性を探るために、天然のMAXとの複合体中の構造と詳細な比較を行ったところ、E16IとL19Vの残基間の2ヵ所の疎水性相互作用がc-Mycのαヘリックス構造の維持に必須であることが示唆された(図3)。
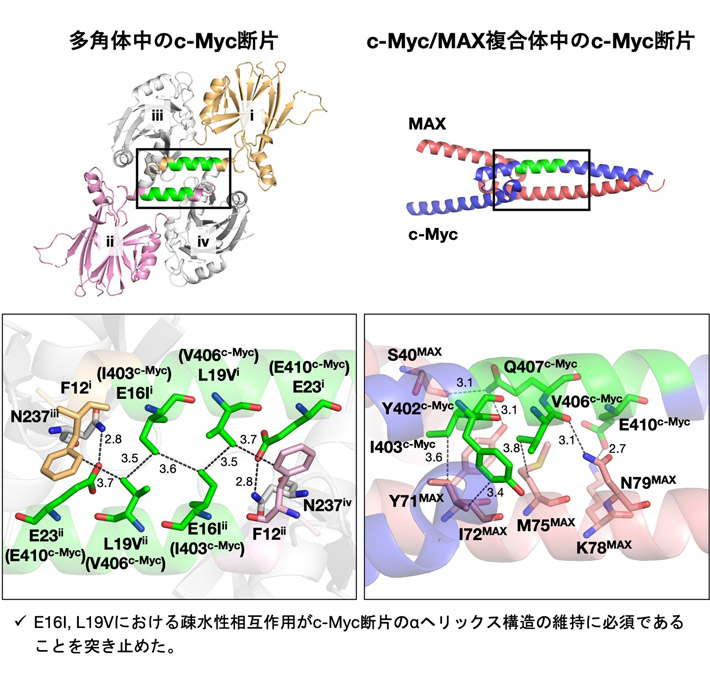
図3. c-Myc由来の11残基を固定化した多角体の結晶構造
その後、得られた結晶構造のコンピュータシミュレーションをもとにc-Mycの周辺環境を変化させた結晶を再設計し、同様の結晶化スクリーニングを4サイクル繰り返した。
最終的に22個の変異体を作製し、うち高分解能の構造解析に成功した8個の結晶構造データをもとに、c-Myc断片をヘリックス構造に固定する重要な分子間相互作用を明らかにした。
今後の展開
IDPは生物機能の理解や創薬分野での注目度が高いにもかかわらず、長らく構造決定のためのアプローチが限られていたターゲットである。本研究により開発したスクリーニング手法は結合パートナーがまだ同定されていない標的IDPの構造決定にも適用可能である。さらに、迅速スクリーニングによって蓄積された多数の結晶構造は、タンパク質結晶のデザインライブラリーの構築に利用でき、他のタンパク質によって支持されるIDPフォールディング機構の解明が加速されると期待される。
社会的インパクト
この迅速CFPCシステムは、多様なIDPにおける複雑な構造‐機能関係を明らかにするための新しいアプローチであり、生物学的プロセスにおけるIDPの役割について、基礎科学的な知見を与える強力なツールとなる。また、社会実装としては、「従来の方法では構造が決定できないタンパク質の構造決定、その構造をもとにした薬剤デザイン」や「ハイスループット性を活用したビッグデータ構築による創薬基盤」へ貢献すると期待される。
付記
本成果は、国立研究開発法人科学技術振興機構「A-step育成型」、「A-step本格型」事業(JPMJTR20U1、JPMJTR224A)、文部科学省科学研究費助成事業(JP19H02830, JP22H00347, JP18H05421, and JP22K19266)、公益財団法人サントリー生命科学財団「SUNBOR SCHOLARSHIP」の支援によるものである。
用語説明
[用語1] 無細胞タンパク質結晶化(Cell-free protein crystallization; CFPC)法 : 細胞から抽出される翻訳機構を利用して、抽出溶液内で組換えタンパク質発現を利用した結晶化方法。従来の結晶化手法と比べ、迅速かつ微量での結晶化が可能である。
[用語2] 天然変性タンパク質(Intrinsically disordered protein; IDP) : 生理的条件下で、決まった立体構造を有しないタンパク質。転写や翻訳といった細胞機能やがんなどのさまざまな疾患においても重要な役割を果たしている。
[用語3] 多角体(Polyhedra crystal; PhC) : 細胞質多角体病ウイルスの感染後期に合成される多角体タンパク質が自発的に集合して結晶化した、タンパク質の結晶構造体。水中や有機溶媒中でも溶解しない高い安定性を有している。細胞内タンパク質結晶化反応で、研究対象として最も広く利用されているタンパク質結晶の一つ。
[用語4] c-Myc : がん原因遺伝子の産物で、パートナー因子であるMAXと相互作用することで転写因子として機能する(S. K. Nair, et al., Cell, 2003)。タンパク質合成、転写、細胞周期を促進し、発がんやがん進展に関与する。
参考文献
[1] M. Kojima et al., ‘Engineering of an in-cell protein crystal for fastening a metastable conformation of a target miniprotein.’ Biomater. Sci. 11, 1350-1357 (2023).
[2] S. Abe et al., Cell-free protein crystallization for nanocrystal structure determination. Sci. Rep. 12, 16031 (2022), 東工大ニュース「無細胞タンパク質合成を用いた迅速なタンパク質結晶の合成」
論文情報
掲載誌 :Proceedings of National Academy of Sciences of United States of America
論文タイトル :High-throughput structure determination of intrinsically disordered protein using cell-free protein crystallization
著者 :Mariko Kojima, Satoshi Abe, Tadaomi Furuta, Kunio Hirata, Xhinchen Yao, Ayako Kobayashi, Ririko Kobayashi, and Takafumi Ueno
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系/
同 科学技術創成研究院 自律システム材料学研究センター
教授 上野隆史
取材申し込み先
東京工業大学 総務部 広報課
理化学研究所 広報室 報道担当