2024-07-01 順天堂大学,国立がん研究センター,自然科学研究機構,電力中央研究所,東京医科歯科大学
発表のポイント
- 光学に関する専門知識を必要としない低コストのDIY光シート顕微鏡システムを開発
- 透明化組織標本について、細胞解像度の網羅的三次元イメージングを容易に実現
- オープンソース化により、すでに国内外の数十研究拠点がシステムを導入・運用中
概要
順天堂大学 大学院医学研究科 生化学・生体システム医科学の大友康平 准教授、大村鷹希 研究員、洲崎悦生 主任教授、自然科学研究機構 生命創成探究センター/生理学研究所 根本知己 センター長・教授、国立がん研究センター研究所 濱田哲暢 分野長を中心とした研究グループは、導入に高額な費用を必要としない透明化組織観察用の光シート顕微鏡を開発しました。descSPIM (デスクスピム) と名付けた本顕微鏡は、オープンソースのパーツリスト、マニュアルを基に、光学に関する専門知識を持たない生物学・医学研究者が自ら構築・運用可能です。すでに量子科学技術研究開発機構 量子医科学研究所 佐原成彦 上席研究員、電力中央研究所 サステナブルシステム研究本部 大塚健介 上席研究員、東京医科歯科大学 大学院医歯学総合研究科 大石由美子 教授らをはじめとする国内外の数十名の研究者に導入され、運用が開始されています。descSPIMは最低限の顕微光学系ながら、三次元的な細胞解像度での組織観察を容易に実現します。さらに、マウスの全脳イメージング、がん移植モデルにおける抗がん剤の三次元分布解析、三次元病理学応用等の高度なアプリケーションにも適用できることも実証しました。本論文はNature Communications誌のオンライン版に2024年6月12日付で公開されました。
背景
生体組織は光学的に不透明であるため、内部の詳細構造を網羅解析するためには、膨大な量の薄切片を、一つ一つ観察する必要がありました。近年、この課題を解決する組織透明化 *1 技術 が提案され、生体組織をまるごと三次元観察することが可能となっています。しかし、化学的手法で実現できる組織透明化法が円熟化していく一方で、これを観察する顕微鏡技術が普及のボトルネックとなっています。自身の実験環境で、生体組織標本の透明化を達成できても、これを細胞レベルの解像度で網羅的に三次元観察するためには特別な顕微鏡装置が必要です。その第一選択肢が光シート顕微鏡 *2 で、組織透明化法と並行して日進月歩で技術発展を遂げています。しかし、本法の導入には高額な費用と光学に関する専門知識のいずれか、または両方が必要であり、誰でもアクセス可能な技術ではありませんでした。そこで本研究グループは、誰もが簡単に組み立てて使用できる、安価なDIY光シート顕微鏡の着想に至りました。
研究成果
シート状の照明光を用いた顕微鏡は 20 世紀の初頭から提案されていましたが、2004 年に蛍光イメージング *3 への応用をErnst Stelzer博士らが報告し、2007 年に組織透明化技術との組み合わせをHans-Ulrich Dodt博士らが報告して以来、幅広く生物学・医学研究に供されています。また、研究者からのニーズに応えるべく、様々な技術開発が行われ、多くの高度なシステムが報告されています。しかしながら、本技術を研究に利用するためには、上述の通り障壁が存在します。まず、市販の光シート顕微鏡システムを導入するには、高額(5000万円~1億円)の導入コストを要します。コストを抑えるためにカスタムの光シート顕微鏡を構築することも可能ですが、高度な光学専門知識が求められます。これは、生体の三次元観察を真に必要とする生物学・医科学を専門とする研究者にとって容易ではありませんでした (図 a)。光シート顕微鏡が身近な共用施設に設置されているプラットフォーム事業のサポートを利用できるといったケースもあり得ますが、日常的な実験作業の中で簡易に幅広い目的で利用するには、2024 年現在、先進国においてなお、まだまだ難がある技術といえます。
高度な顕微鏡システムの一つとして市販化されている光シート顕微鏡ですが、2004 年にStelzer博士らがSPIM (Selective Plane Illumination Microscopy) と命名して報告したもともとの光学系は極めてシンプルなものでした (図 b)。照明に用いるレーザー光を光ファイバーで光学系に導き、一枚の凸レンズで数mm径の平行なビーム光とし、これを一枚のカマボコ形状のレンズ (シリンドリカルレンズ) でシート状に集光して標本に照射します。蛍光検出用の対物レンズは、光シートによる断層像が撮影できるよう、直交配置されます。光シート照射面からの蛍光は対物レンズで集められ、余剰な他波長成分を光フィルターで除去した後に、チューブレンズにてカメラの受光素子に結像されます。本研究グループは、最小限の光学系でSPIMを実現する方法論の提案が、多くの生物学・医学研究者が真に知りたい「興味対象である標的細胞は、三次元組織の中のどこで何をしているのか」の問いを解く一助になると着想しました (図 a)。
これを実現するために、自身の実験デスクの傍に設置しても差し支えがない 300 mm × 450 mmのアルミ製のブレッドボード上で実現できるSPIM光学系 (descSPIM; deskside-equipped SPIM for tissue-clearing technology users) を考案しました。100 に満たない光学部品を、プラモデルを組み立てる感覚で、数時間の間に組み立てることが可能です (図 c)。レーザー光の色の数に依存しますが、単色なら 300 万円、4 色としても 500~600 万円で導入できます。高度な専門知識を必要とせず、マニュアル通りに配置し、ネジ止めをしていけば、透明化した臓器標本を丸ごと細胞解像度で三次元イメージングできる光シート顕微鏡が完成します。組織透明化技術の主要な対象であるマウスの脳について、数mm厚のスライス標本や半脳であれば、数分で三次元観察が可能です (図 d)。さらに大きなマウスの全脳についても、複数の三次元像を取得して、画像解析で広く使われるImageJ *4 のプラグインを用いて繋ぎ合わせることにより、細胞解像度の全脳三次元像を再構成できることを立証しました (図 e)。
また、摘出したがん組織のような多細胞体に対してもdescSPIMは有用性を発揮します。国立がん研究センターの濱田哲暢 分野長の研究グループで樹立したがん細胞株移植片 (CDX; cell-line derived xenograft) *5 モデルについて、蛍光色素標識した抗がん剤を血中投与した後に腫瘍塊を摘出し、透明化して観察に供しました。その結果、微小血管ネットワークと抗がん剤の組織内の分布を三次元的に可視化することに成功しました (図 f)。抗がん剤の分布の不均質性や周辺血管との相関解析により、新薬の開発・スクリーニングや薬物動態解析において非常に有用性が高いデータを与えることが期待されます。さらに、近年の病理学における最先端トレンドであるデジタル化・三次元化のデモンストレーションにも成功しました。CDXモデルマウスから摘出した腫瘍塊を 2 mm厚のスライスとし、透明化するとともに細胞核と細胞質を蛍光標識し、イメージングを行いました。この標識対象は病理解析のゴールドスタンダードであるヘマトキシン&エオジン (HE) 染色が標識しているものとほぼ同等です。このことから、擬似カラーをHE染色標本と同じ色調に変換することで、三次元的な病理標本イメージを得ることができます (図 g)。デスクサイド観察のコンセプトを崩さずに、本技術を病理学分野に受け入れられるクオリティまで高められれば、診断の効率化への多大な貢献が期待できます。
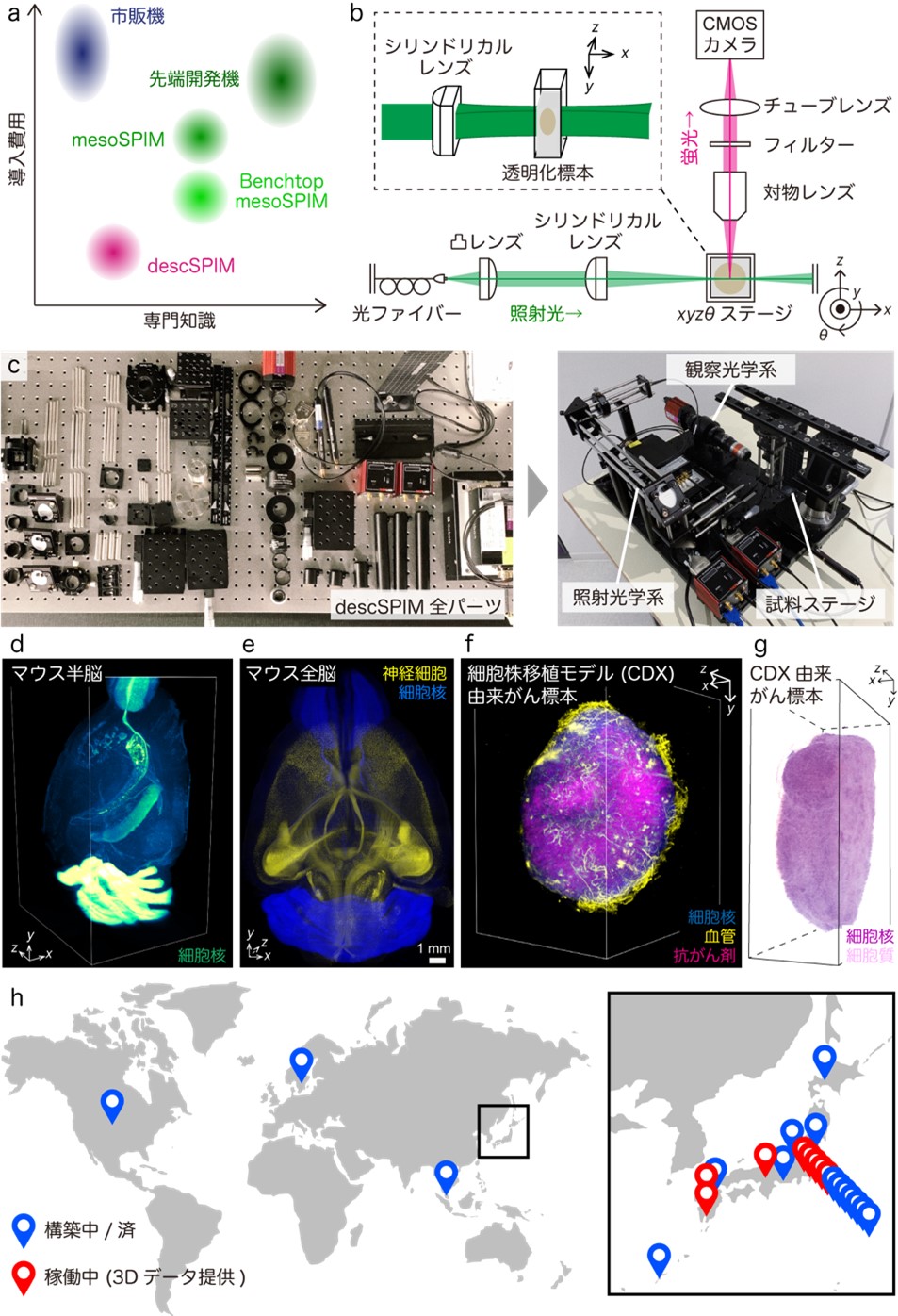
図:descSPIMの概略。(a) 専門知識vs導入費用プロットにおける位置付け。(b) 基本的なSPIM光学系の概略。(c) descSPIMの全パーツと組み立て後の外観。(d) 細胞核を蛍光染色し、透明化したマウス半脳の三次元イメージ。(e) 神経細胞の一部に蛍光タンパク質を発現する遺伝子改変マウス脳の細胞核を異なる色で蛍光染色し、透明化した全脳標本の三次元イメージ。(f) 蛍光色素を標識した抗がん剤を投与したがん細胞株移植 (CDX) モデルマウスから摘出した腫瘍を透明化し、血管および全細胞核を蛍光標識して取得した三次元イメージ。(g) CDXモデルマウスから摘出した腫瘍塊を 2 mm厚にスライスし、透明化し、細胞核と細胞内のタンパク質を蛍光標識して取得した三次元イメージ。ヘマトキシン&エオジン染色の色調に擬似カラー変換した。(h) 国内外のdescSPIM設置拠点。
展望
今回、本研究グループは、透明化組織標本を日常的に三次元観察するための新たな光シート顕微鏡descSPIMを提案しました。従来のコンセプトである生物学・医学研究の現場における即戦力としてのポテンシャルを示すと同時に、最低限のSPIM光学系でも、高度なアプリケーションに適用可能であることも立証しました。一方でdescSPIMは、顕微鏡ハードウェアとしても、高度化できるポテンシャルを多く有しています。光シート顕微鏡は比較的新しい技術として、現在も様々な機能指標に関する研究開発が行われています。これらの要素技術を積極的にdescSPIMに取り込むことは、最先端バイオイメージング技術を生物学・医学研究の現場にいち早く届ける一助となるはずです。既に本研究グループは、「お手軽なデスクサイド3D観察」のコンセプトを維持しながら、descSPIMの高度化に着手しています。
また、descSPIMのコンセプトは 2023 年の 5 月にbioRxivにプレプリントを公開し(https://www.biorxiv.org/content/10.1101/2023.05.02.539136v1)(外部サイトにリンクします)、同時にGitHubを通じてパーツリスト、構築・調整・撮像マニュアル、解析・測定コードをオープンソース化しました (https://github.com/dbsb-juntendo/descSPIM)(外部サイトにリンクします)。さらに、科学研究費助成事業 学術変革領域研究の先端バイオイメージングプラットフォーム (ABiS; Advanced Bioimaging Support platform) 事業の枠組みにおいて、支援対象者への組織透明化技術を含めた個別コンサルティング、順天堂大学における構築チュートリアルを継続的に実施しています。今回の成果発表に先立ち、すでに国内外の数十研究拠点にdescSPIMが設置され、目下稼働中です (図 h)。この中で、もともと顕微鏡システムをブラックボックスとして捉えていた多くの生物学・医学研究者は、顕微鏡や光学の原理理解を深めることが取得画像の質向上に直結することを実感しています。descSPIMを導入済みの複数の研究グループが、自身の興味対象に合わせてシステムを様々な方向に高度化している事実は、これを象徴しています。「無いものは作る」という哲学はこれまでも可視化解析技術の水準を高め続けてきましたが、descSPIMはこれを加速するプラットフォームとして、生物学・医学研究分野と光工学・応用物理学とを橋渡しすることにより、研究水準の底上げに貢献していくことが期待されます。
発表論文
雑誌名
Nature Communications
タイトル
descSPIM: an affordable and easy-to-build light-sheet microscope optimized for tissue clearing techniques
著者
Kohei Otomo, Takaki Omura, Yuki Nozawa, Steven Edwards, Yukihiko Sato, Yuri Saito, Shigehiro Yagishita, Hitoshi Uchida, Yuki Watakabe, Kiyotada Naitou, Rin Yanai, Naruhiko Sahara, Satoshi Takagi, Ryohei Katayama, Yusuke Iwata, Toshiro Shiokawa, Yoku Hayakawa, Kensuke Otsuka, Haruko Watanabe-Takano, Yuka Haneda, Shigetomo Fukuhara, Miku Fujiwara, Takenobu Nii, Chikara Meno, Naoki Takeshita, Kenta Yashiro, Juan Rosales Rosales Rocabado, Masaru Kaku, Tatsuya Yamada, Yumiko Oishi, Hiroyuki Koike, Yinglan Cheng, Keisuke Sekine, Jun-ichiro Koga, Kaori Sugiyama, Kenichi Kimura, Fuyuki Karube, Hyeree Kim, Ichiro Manabe, Tomomi Nemoto, Kazuki Tainaka, Akinobu Hamada, Hjalmar Brismar, Etsuo A Susaki
DOI
https://doi.org/10.1038/s41467-024-49131-1(外部サイトにリンクします)
掲載日
2024年6月12日付(オンライン)
URL
https://www.nature.com/articles/s41467-024-49131-1(外部サイトにリンクします)
研究費
本研究はAMED (JP19dm0207078, JP20gm6210027, JP21ak0101181, JP21cm0106286, JP21gm1410009, JP21wm0425001, JP21wm0425003, JP21zf0127004, JP223fa827004, JP22ama221517, JP23ama221220, JP23bm1123032, JP23bm1423012, JP23gm6510018, JP23nk0101665)、JST (JPMJCR20E4, JPMJCR23B7, JPMJMS2023, JPMJTR22UA)、JSPS科研費 (JP19H04274, JP19K06896, JP20H03549, JP20H05669, JP21H02665, JP21H03127, JP21H05241, JP21K19346, JP21K19358, JP21K19895, JP21K20703, JP22H02523, JP22H02756, JP22H02824, JP22H03141, JP22H04926, JP22K06810, JP22K183838, JP22KK0100, JP23H02878, JP23K18081, JP23K20044)、アメリカ国立衛生研究所COBREプログラム、UTEC-UTokyo、武田科学振興財団、中谷医工計測技術振興財団、持田記念医学薬学振興財団、上原記念生命科学財団、ネブラスカ州タバコ集落生物医学研究開発基金、国立がん研究センター研究開発費、高松宮妃癌研究基金の支援を受け多施設との共同研究の基に実施されました。本研究にご協力いただいた皆様に深く感謝いたします。
用語説明
注1 組織透明化
生体組織標本について、脱色・脱脂・屈折率調整等の化学的処置のいくつかを組み合わせて施すことにより、光学的に透明化する手法。
注2 光シート顕微鏡
照明光を薄いシート状に集光し、直交配置した対物レンズにて蛍光を検出し、スライス観察を行う顕微鏡。原理上、観察面以外の組織が光照射に曝されることが無いため、光毒性・蛍光分子の褪色が起こりづらい。
注3 蛍光イメージング
照射光を吸収し、やや長波長の光 (蛍光) を放出する分子で生体を標識し、顕微鏡で可視化する技術。
注4 ImageJ
アメリカ国立衛生研究所で開発されたオープンソース・パブリックドメインの画像処理ソフトウェア。
注5 がん細胞株移植片 (CDX)
がん細胞株をマウスに移植して腫瘍を作成すること。
研究者のコメント
これまでも顕微鏡技術に関する研究を行ってきましたが、3年前に医学部に着任し、アンメットニーズに触れ、フィードバックを受けることで完成した顕微鏡です。技術先鋭化とは異なる視点から、現場で役に立つ顕微鏡を作ることができたと自負しています。コンセプトを提示いただき、時には徹夜で完遂にお付き合いいただいた洲崎悦生 主任教授、研究室の皆様、我々を信じ、試料提供や自身の拠点へ技術導入いただいた先生方に深く感謝いたします。(大友 康平)
お問い合わせ先
研究に関するお問合せ
順天堂大学大学院医学研究科生化学・生体システム医科学
主任教授 洲崎 悦生(すさき えつお)
国立がん研究センター研究所 分子薬理研究分野
分野長 濱田 哲暢(はまだ あきのぶ)
自然科学研究機構 生命創成探究センター バイオフォトニクス研究グループ センター長・教授
自然科学研究機構 生理学研究所 バイオフォトニクス研究部門 教授
根本 知己(ねもと ともみ)
電力中央研究所 サステナブルシステム研究本部 生物・環境化学研究部門
上席研究員 大塚 健介 (おおつか けんすけ)
東京医科歯科大学 大学院医歯学総合研究科 病態代謝解析学分野
教授 大石 由美子 (おおいし ゆみこ)
広報窓口
順天堂大学 総務局 総務部 文書・広報課
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
自然科学研究機構 生命創成探究センター 研究戦略室
自然科学研究機構 生理学研究所 研究力強化戦略室
電力中央研究所 広報グループ
東京医科歯科大学 総務部総務秘書課広報係