2024-09-04 東京大学
発表のポイント
- 尿路病原性大腸菌の接触依存性増殖阻害タンパク質(CdiA-CT)は隣接細菌内でアミノ酸生合成酵素(CysK)によって活性化され、tRNAを切断し、隣接細菌の増殖を抑制します。
- CysK:CdiA-CT:tRNAからなる三者複合体の立体構造をクライオ電子顕微鏡を用いて解析し、CdiA-CTとCysKが複合体を形成することで、CdiA-CTの構造が安定し、活性触媒部位が形成されることによりCdiA-CTによるtRNAの認識と切断が促進されることを解明しました。
- 細菌の生存競争において、細胞内のアミノ酸生合成酵素を本来の機能とは異なったtRNA切断タンパク質の活性化足場として利用するという新たな分子機構を明らかにしました。
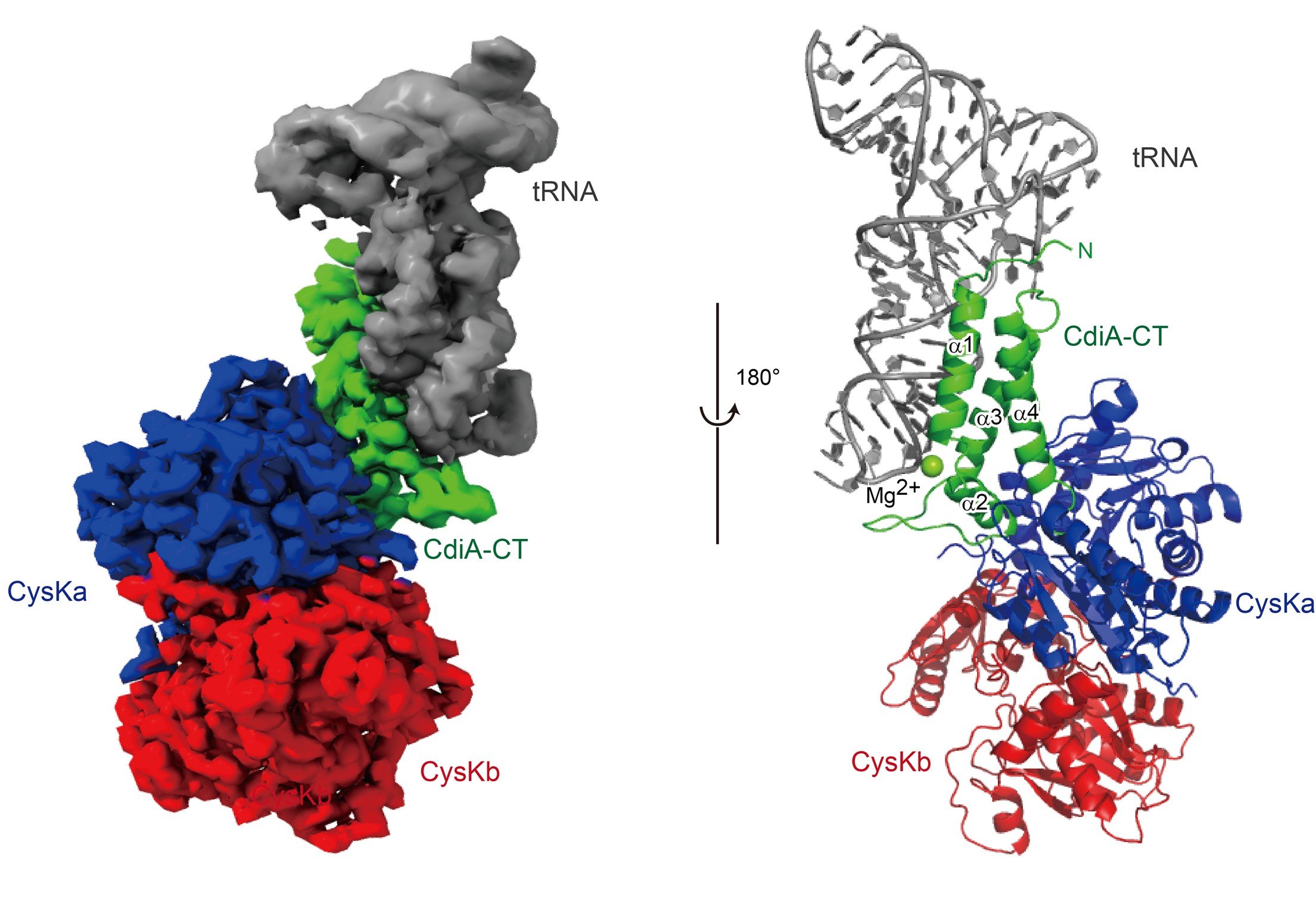
尿路病原性大腸菌CdiA-CT:CysK複合体によるtRNA認識、切断
発表概要
東京大学大学院新領域創成科学研究科メディカル情報生命専攻の馮炤航(ヒョウ ショウコウ/FENG, Zhaohang)大学院生(修士課程)と富田耕造教授らの研究グループは、尿路感染症を引き起こす尿路病原性大腸菌EC536株の接触依存性増殖阻害(Contact-dependent growth inhibition:CDI、注1)タンパク質(CdiA-CT)がアミノ酸の生合成に関わるCysKタンパク質(注2)と結合することにより構造が変化し活性化され、その結果、tRNA(注3)を認識し切断する分子機構を明らかにしました。
腸管出血性大腸菌や尿路病原性大腸菌などの病原性細菌が持つCDIは、隣接する他の同種細菌にCdiA-CTを挿入し、その細菌の増殖を阻害することで生じます。CDIは細菌間の生存競争システムの一つであり、病原性細菌が他の細菌の増殖を抑え、自身のみが増殖することで、病原性細菌感染症の蔓延を引き起こします。
本研究では、病原性細菌の生存競争に関わる現象において、細胞内のアミノ酸生合成タンパク質がtRNA切断タンパク質であるCdiA-CTの安定化および活性化の足場として利用されるというユニークな分子機構を解明しました。本研究成果の活用により、病原性細菌特有の新たな薬剤の開発が期待されます。
本研究成果は、9月4日に『Nucleic Acids Research』誌にオンライン掲載されました。
発表内容
接触依存性増殖阻害(CDI)は、細菌間の生存競争に関わる現象で、病原性細菌において広く見出されます。CDIは、細菌の接触依存性増殖阻害タンパク質前駆体(CdiA)とその受容体を介した隣接標的細菌との相互作用、そして、CdiAのカルボキシ末端(注4)側に存在する毒素ドメインタンパク質(CdiA-CT)の隣接標的細菌内への輸送といった一連のプロセスによって進行します。隣接する細菌内にCdiA-CTが送り込まれると、その細菌の増殖はCdiA-CTの作用で抑制されます。CdiA-CTは多様性に富んでおり、細胞膜への孔形成活性(pore-forming、注5)、rRNAやtRNAなどを標的としたRNA分解活性、DNA分解活性などを持つものがあることが知られています。
尿路感染症を引き起こす大腸菌EC536株のCdiA-CTは、tRNAのアンチコドン(注6)を含むループ領域を切断する活性を持ち、tRNAを不活性化することによりタンパク質合成を阻害し、標的細菌の増殖を抑制する作用があることが知られています。これまで大腸菌EC536株CdiA-CTのtRNA切断活性にはシステイン生合成に関わるCysKタンパク質を必要とすること、CdiA-CTがCysKと複合体(CysK:CdiA-CT複合体)を形成することが報告されていました。しかし、大腸菌EC536株のCdiA-CTの基質となるtRNAの認識機構やCysKによるCdiA-CTのtRNA切断活性化の分子機構については明らかになっていませんでした。
本研究では、大腸菌EC536株由来のCdiA-CTに注目し、CysK:CdiA-CT複合体とtRNAとの三者複合体のクライオ電子顕微鏡(注7)を用いた単粒子構造解析を行い、その3次元構造の決定に成功しました(動画)。また、構造を基にした機能解析をも行いました。
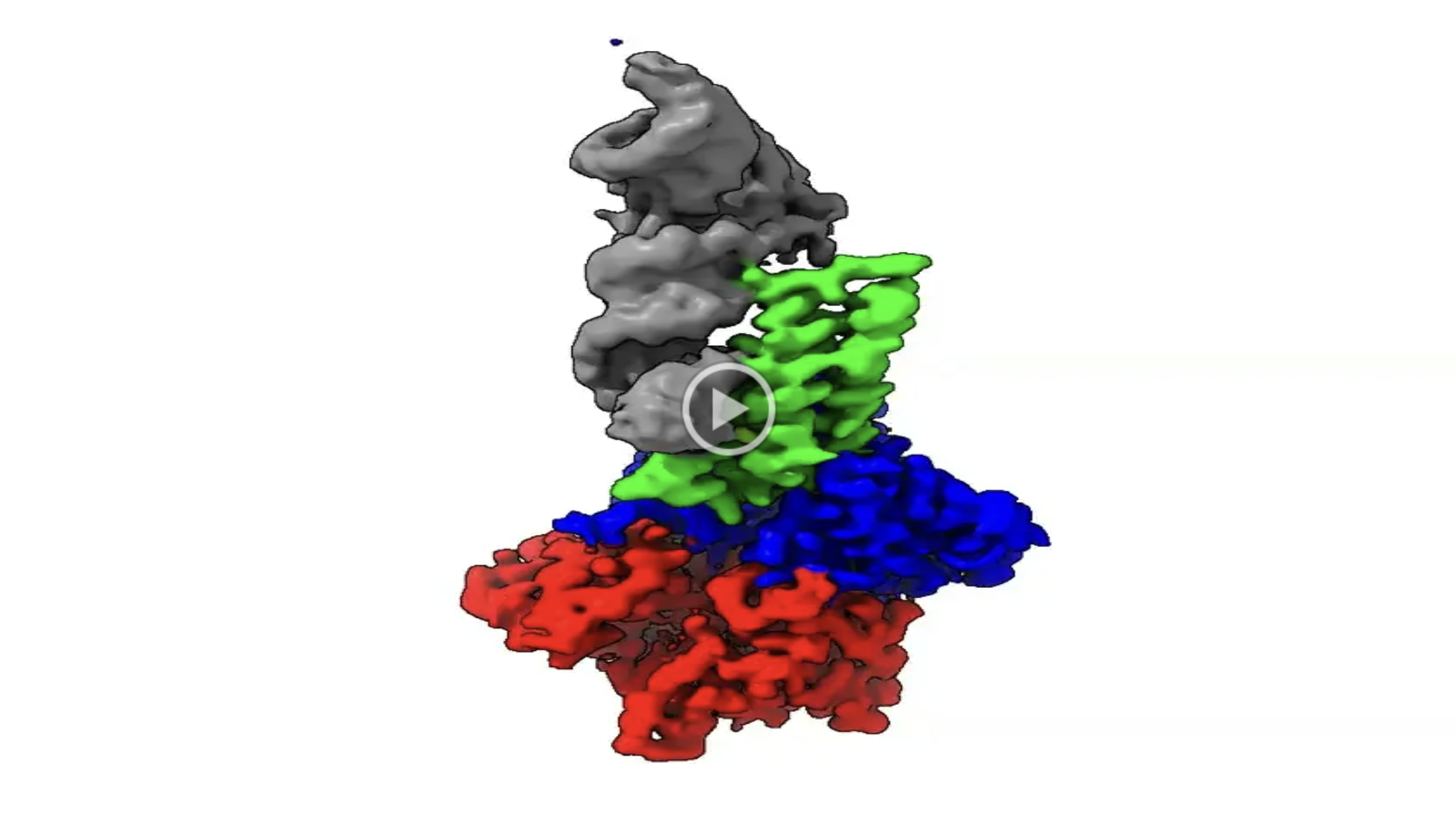
動画 CysK:CdiA-CT複合体とtRNAとの三者複合体構造
(tRNA:灰色、CdiA-CT:緑、CysK:青、赤)
https://drive.google.com/file/d/1ypn4bCa1c2FBoVB-1n805-QCLsKkh1wi/view?usp=drive_link
その結果、以下の(i)~(v)が明らかになりました。
i) tRNAはCysKとは全く相互作用せず、CdiA-CTとのみ相互作用する。
ii) CdiA-CTはCysKと結合することによって構造変化を起こし、その構造が安定化する。
iii) CdiA-CTとCysKの結合によってCdiA-CT内にtRNAを切断する活性触媒ポケットが形成される。
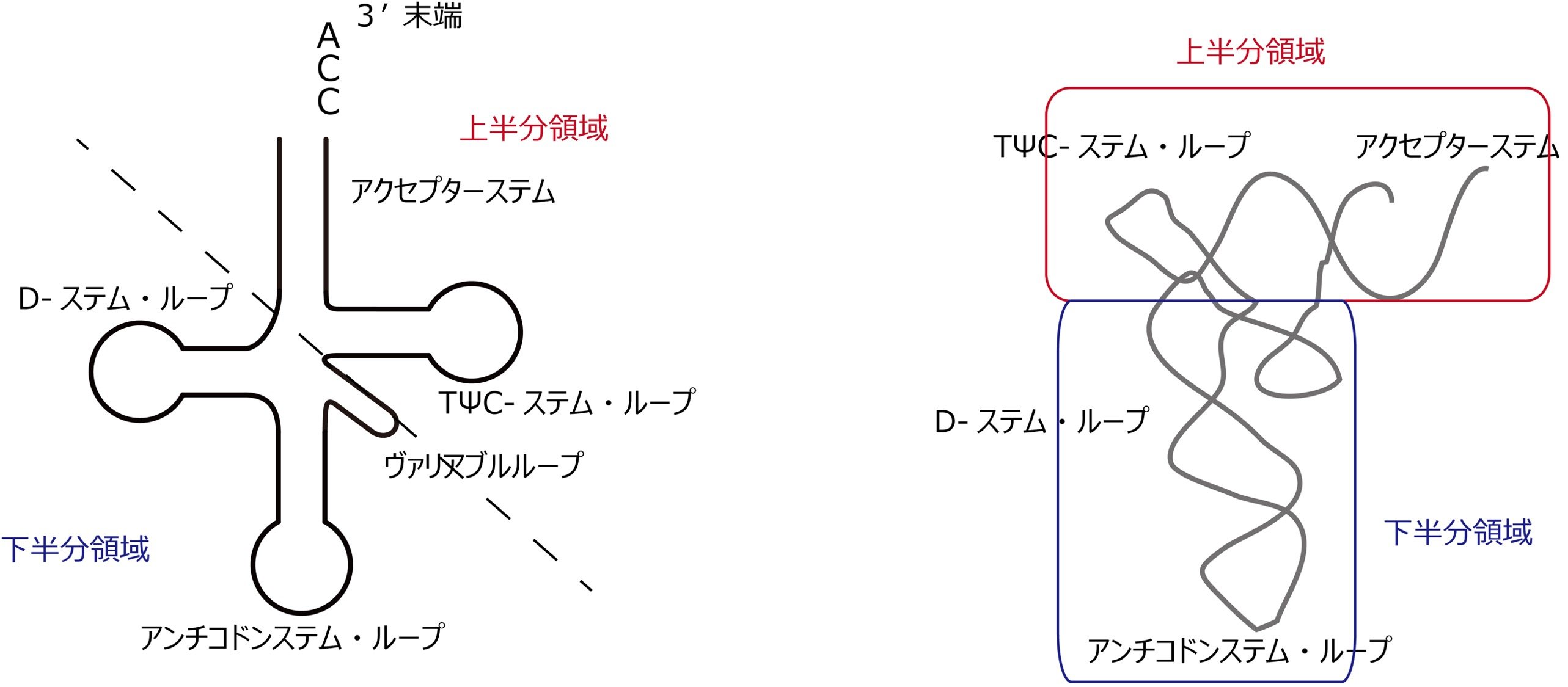
iv) CdiA-CTはtRNAの下半分領域(Dステムアームおよびアンチコドンステムアーム、注3)のヘリックス構造を認識し、ヘリックスの溝をつかむように結合する。
v) 結果、tRNAのアンチコドンループ領域がCdiA-CTの触媒ポケットに位置し、tRNAが切断される。
以上より、CysKがCdiA-CTを活性化し、tRNAを切断する「足場(platform)」として機能していることが明らかになりました(図)。
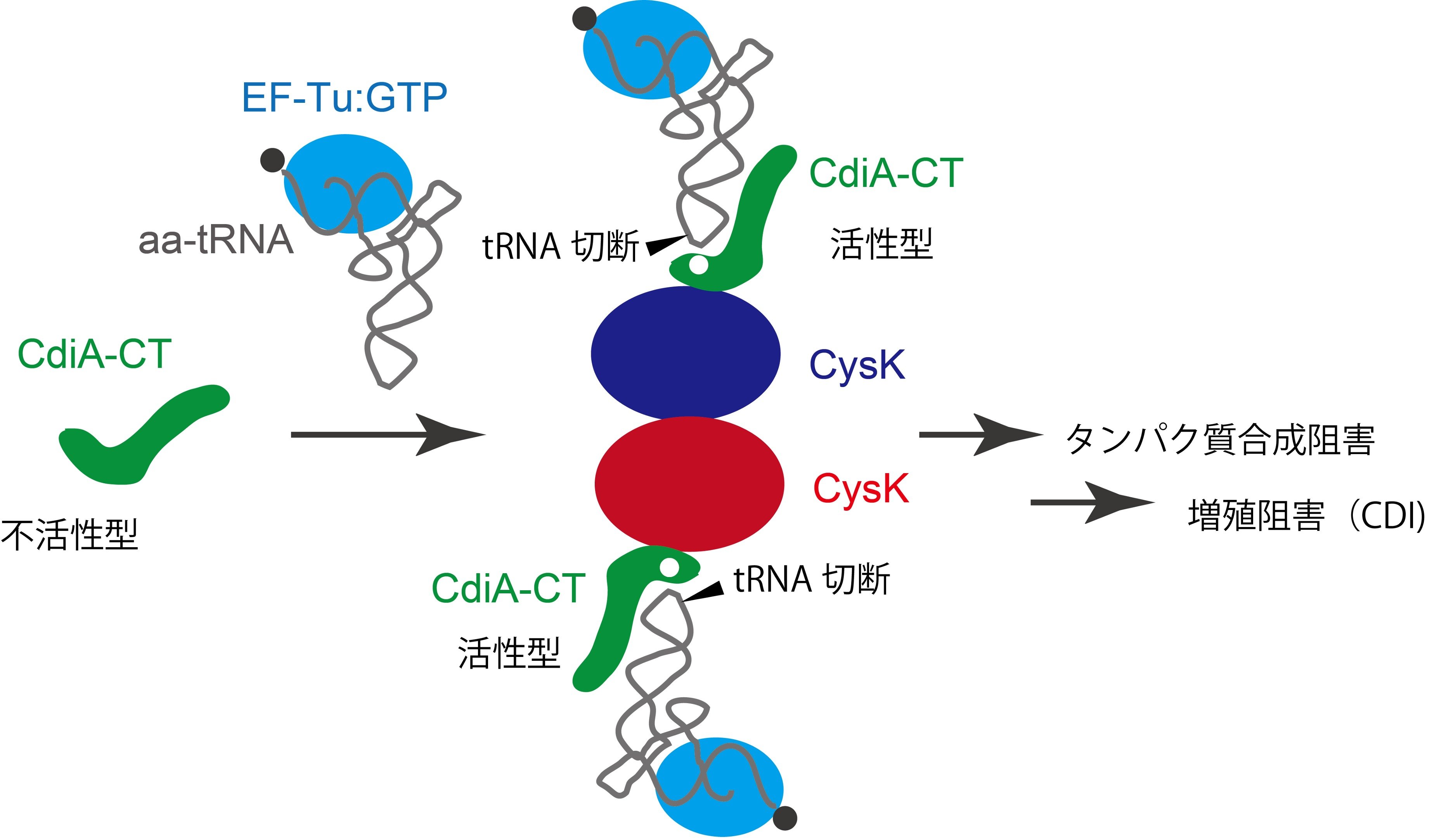
図 CysKはCdiA-CTを活性化させる足場として働く
本研究成果は、アミノ酸の生合成に関わる酵素が、その酵素活性とは関係なく、細菌の生存競争に関与するCdiA-CTを活性化する足場として機能するユニークな分子機構を明らかにしたものです。本研究成果の活用により、病原性細菌特有のCysKによるCdiA-CTの活性化を阻害する新たな薬剤の開発が期待されます。
〈関連するプレスリリース〉
細菌の生存競争に関わるタンパク質の活性化の分子機構を解明〜翻訳因子のこれまで知られていなかった新たな機能の発見〜(2022年4月12日)
発表者・研究者等情報
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
馮 炤航 修士課程
八代 悠歌 特任助教
富田 耕造 教授
論文情報
雑誌名:Nucleic Acids Research
題 名:Mechanism of activation of contact-dependent growth inhibition tRNase toxin by the amino acid biogenesis factor CysK in the bacterial competition system
著者名:Zhaohang Feng, Yuka Yashiro, and Kozo Tomita*
DOI: 10.1093/nar/gkae735
URL: https://www.doi.org/10.1093/nar/gkae735
研究助成
本研究は、日本学術振興会科学研究費助成事業 基盤研究A(課題番号:23H00368、18H03980)、武田科学振興財団 ハイリスク新興感染症研究助成、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)(課題番号:JP23ama121002)などの支援により実施されました。
用語解説
(注1)接触依存性増殖阻害(Contact-Dependent growth Inhibition:CDI)
隣接する細菌の増殖を阻害することにより、特定の細菌が優先的に増殖する細菌間の生存競争システムであり、数多くの病原性細菌に見出されている。大腸菌の場合、CDIを司る遺伝子は、cdiA、cdiB、cdiIである。CdiAは、アミノ末端(注4)が細胞表面から突出したフィラメント状構造をとり、受容体結合ドメイン(RBD)とカルボキシ末端(注4)側の活性ドメイン(CdiA-CT)から構成される。CdiBは外膜タンパク質であり、CdiAはCdiBを介して細胞外へ輸送され、CdiAのRBDが隣接する細菌の受容体に結合すると、CdiAは自己タンパク質分解活性により活性ドメインCdiA-CTを切りはなし、CdiA-CTは標的細菌内に移行する。CdiIは、CdiA-CT:CdiI複合体を形成することでCdiA-CTの活性を抑制し、細胞を自己毒から守る免疫タンパク質であり、対応するCdiIを持たない細菌の増殖は、CdiA-CTによって阻害される。
(注2)CysKタンパク質
アセチルセリンと硫化水素からシステインを合成するシステイン生合成酵素。CysKタンパク質はO-アセチルセリンスルフヒドリラーゼ(O-acetylserine sulfhydrylase)であり、O-アセチルセリン(OAS)と硫化物からアミノ酸であるシステインを合成する反応を触媒する。
(注3)tRNA(transfer RNA)
転移RNA。通常76-90ヌクレオチドからなるRNA分子であり、タンパク質をコードするメッセンジャーRNA(mRNA)とそのアミノ酸配列とを結びつけるアダプター分子として働く。tRNAはクローバーで言い表される2次構造をとり、アクセプターステム、D-アーム、アンチコドンステム・ループ、バリアブルループ、TΨCステム・ループからなる。また、L字型で言い表される3次元構造をとっており、アクセプターステムとTΨCステム・ループからなる上半分領域と、D-アームとアンチコドンステム・ループからなる下半分領域が相互作用した構造をとる。3’末端にはCCA配列があり、その3’末端にアミノアシル合成酵素によってアミノ酸が付加される。
(注4)アミノ末端、カルボキシ末端
タンパク質の末端には、タンパク質が合成されはじめる側の末端と合成が終了する側の末端があり、それぞれアミノ末端、カルボキシ末端と呼ぶ。
(注5)孔形成活性(pore-forming)
細胞膜を貫通する細孔を形成すること。CDIに関わるタンパク質のうち、標的細菌の細胞膜に細孔を形成することにより、標的細菌の増殖を抑制するものもある。
(注6)アンチコドン
mRNA上の遺伝暗号(コドン)と対合するtRNA内部の領域のこと。
(注7)クライオ電子顕微鏡
試料を極低温で急速凍結し、電子顕微鏡で撮影した多数の画像から高分解能のもとに3次元構造を再構築する技術。この方法により、タンパク質や複合体などの分子構造を原子レベルで観察できる。
お問い合わせ
新領域創成科学研究科 広報室