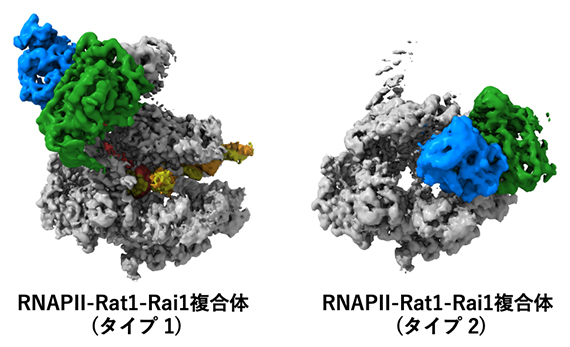
2024-09-20 東京大学
発表のポイント
- 非標識かつ1分子レベルで対象分子を測定できるナノポア計測技術を用いて、転写活性の高いヒストンバリアントH2A.Bを含むヌクレオソームが崩壊しやすいこと、その崩壊過程が通常型のヌクレオソームと異なる経路をとることを示した。
- ナノポアを用いて実際に生体内での転写時に加わる力を模倣することで、ヌクレオソームDNAの巻き戻し過程を計測することに成功した。さらにMDシミュレーションを実施したことでナノポア通過時の詳細な分子動態のモデルを考案することができた。
- 転写時におけるDNAのヒストンからの巻き戻し過程を理解する新しいツールを開発したことによって将来的に転写制御に関わる詳細な仕組みを応用し、治療薬開発に貢献できる可能性を示しました。
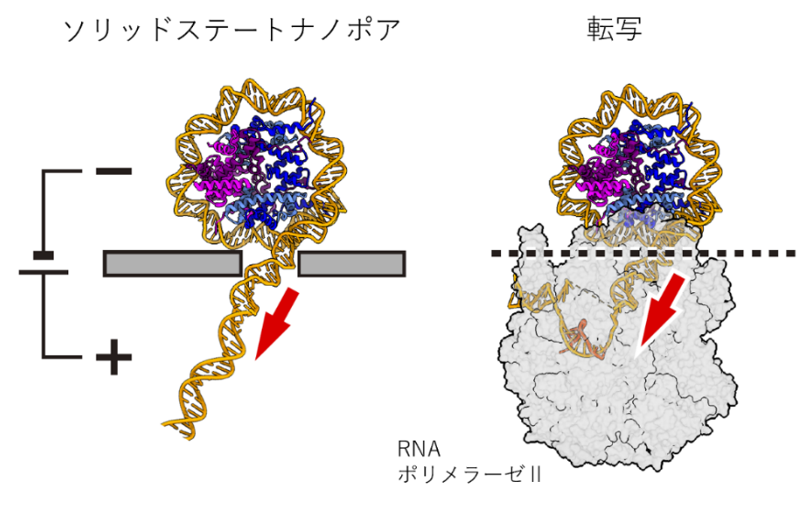
ナノポア測定による転写時に加わる力を示した概念図
発表概要
東京大学大学院理学系研究科の上村想太郎教授、野澤光輝修士課程生、荻原智修士課程生、平野里奈博士課程生(研究当時)、赤津 綜隆博士課程生、飯塚怜助教らは、東京大学定量生命科学研究所の胡桃坂仁志教授、鯨井智也助教、京都大学理学研究科の高田彰二教授、長江文律立博士課程生、長岡技術科学大学産学融合トップランナー養成センターの山崎洋人産学融合特任講師らとの共同研究でソリッドステートナノポア(注1) を用いて、ヒストンバリアント(注2) H2A.Bを含むヌクレオソーム(注3)では通常型のヌクレオソームと比べてDNAが巻き戻されやすく、その過程でヒストンが解離しやすくなっていることを明らかにしました。
ヒストンバリアントH2A.Bを含むヌクレオソームは、精巣やがん細胞に局在していることが明らかにされており、転写の活性化などに関与していることが示唆されています。しかし、その転写活性化の機構は明らかにされていませんでした。本研究では、ナノポア計測という手法を用い、転写様式を模したDNAの巻き戻しを行いながらその崩壊過程を計測することで、H2A.Bを含むヌクレオソームの構造安定性が低下することを明らかにしました。さらに、その崩壊過程には不均一な経路が存在することも明らかになりました。この実験手法は、転写時のヌクレオソームの動態を解析する重要なものになると期待されます。
発表内容
研究の背景・先行研究における問題点
ヌクレオソームとは、ヒストンというタンパク質の八量体にDNAが巻き付いたもので、真核生物のゲノムDNAはヌクレオソームが連なった構造を取っています。ヌクレオソーム中のヒストンH2Aがタンパク質の一種H2A.Bに置き換えられるヒストンH2A.Bは、精巣やがん細胞に局在し、転写の活性化などに関与することが示唆されています。しかし、その転写活性化の機構は明らかにされていませんでした。
RNAポリメラーゼ(注4)による転写過程では、DNAをヒストンから巻き戻してヌクレオソームを崩壊させていることから、DNA-ヒストン間の結合強度は転写活性の制御に重要な役割を果たしていると言えます。従来の研究におけるヌクレオソームのDNA巻き戻し過程の1分子計測では、光ピンセット(注5)や高速AFM(注6)が用いられてきました。しかし、RNAポリメラーゼはヌクレオソームを押さえつけながらDNA-ヒストンの結合部位に対して張力を加えている一方で、既存手法はこの状況を再現できていませんでした。
本研究グループは、DNA巻き戻し過程を計測する手法としてソリッドステートナノポアを用いることで、より転写時に近い条件でDNAの巻き戻しを行い、さらにその崩壊過程について解明できるのではないかと考えました(図 1)。この計測により、H2A.Bを含むヌクレオソームが転写を活性化させる機構を解明できると期待されます。
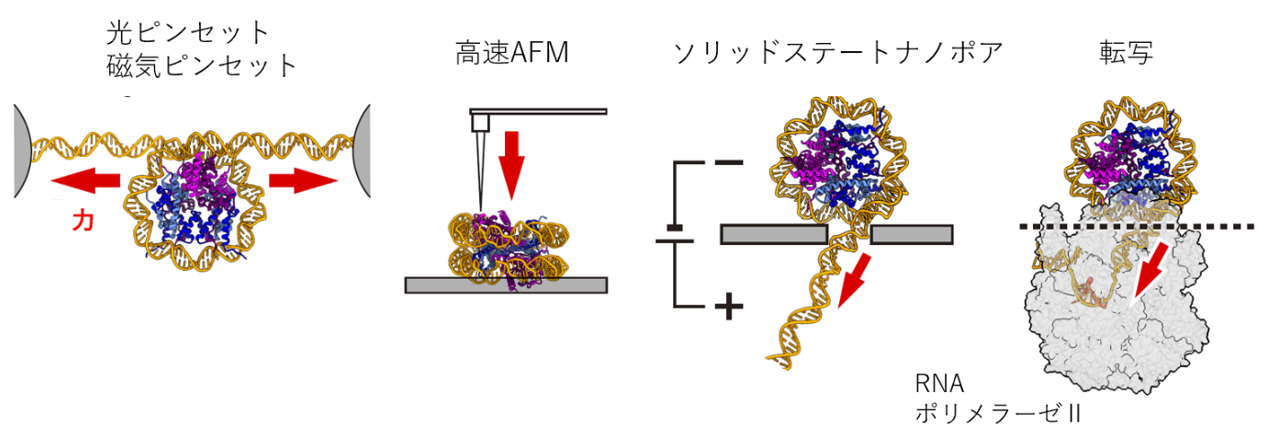
図1:従来の計測手法とナノポア計測の比較
転写時(右)では、RNAポリメラーゼはヌクレオソームを押さえつけて片側からDNAを引っ張っている一方で、高速AFMではヌクレオソームに対して垂直な力が、光ピンセットではDNAの両側からの張力がかかっている。ソリッドステートナノポアを用いた計測では、転写時のようにヌクレオソームを押さえつけ、DNAに張力を加えることができる。
研究内容
まず、通常型のヌクレオソーム(H2Aヌクレオソーム)とH2A.Bを含むヌクレオソーム(H2A.Bヌクレオソーム)をナノポアに通過させる実験を、さまざまな電圧の下で行いました。得られた封鎖信号(阻害された電流量)の継続時間と封鎖率(封鎖信号を完全にポアが阻害された電流量で割った値)を算出し散布図を作成したところ、通常型ヌクレオソームでは300 mVで、H2A.Bヌクレオソームでは200 mVで新たな分布が現れることが確認されました(図 2)。引き込まれる負荷が強くなればなるほどこの分布の通過時間が短くなっていくことから、 DNAが巻き戻されてポアを通過するようになった分布であるとわかりました。H2A.Bヌクレオソームは通常型のヌクレオソームよりも弱い負荷でヌクレオソームが崩壊し、巻き戻されるという結果が得られました。すなわち、ヌクレオソームのヒストンH2AがヒストンバリアントH2A.Bに置き換えられることで、構造安定性が低下するということを明らかにしました。
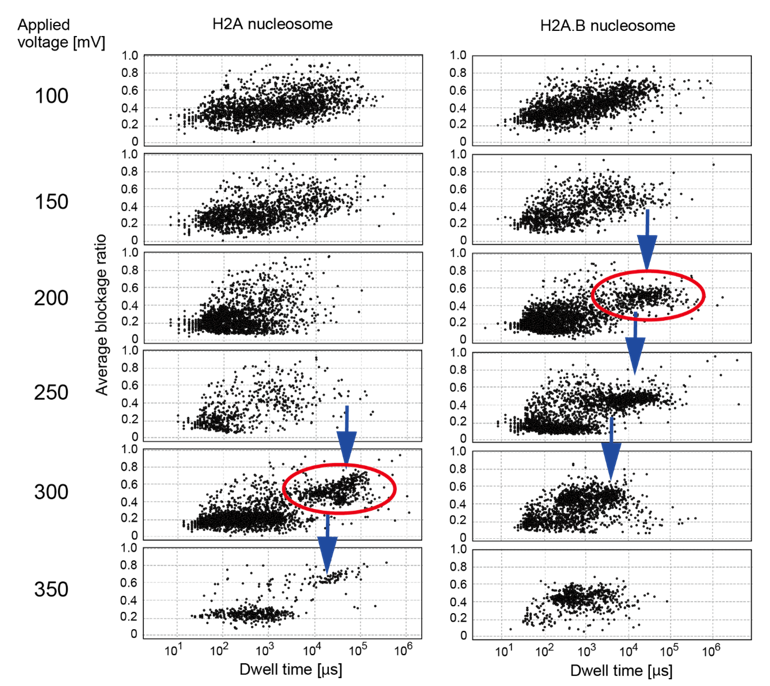
図2:ヌクレオソーム計測時の封鎖信号の継続時間(横軸)と封鎖率(縦軸)の散布図。
左が通常型のヌクレオソーム、右がH2A.Bヌクレオソームの結果。印加電圧は、上から順に100 mVから50 mVずつ増えていく。赤い丸が新たに現れた分布を表している。
通過過程を詳細に解析するため、得られた波形を重ね合わせて描画したところ、H2A.Bヌクレオソームでは図3の赤四角で囲われた部分の深い電流値が通常型ヌクレオソームと比べて少ないことが明らかになりました(図 3)。これはヌクレオソーム崩壊過程において、H2A.Bヌクレオソームはポアを大きく塞がないということを示しています。そのため、崩壊過程において通常型ヌクレオソームではH2A-H2BダイマーがDNAとともにポアを塞ぐ一方で、H2A.B-H2BヒストンダイマーはDNAから速やかに解離するのではないかと考えられます。そこで、ヌクレオソーム粗視化モデルを用いた分子動力学シミュレーション(MDシミュレーション:注7)を行ったところ、そのようなポア通過時の分子の様子が再現されました。
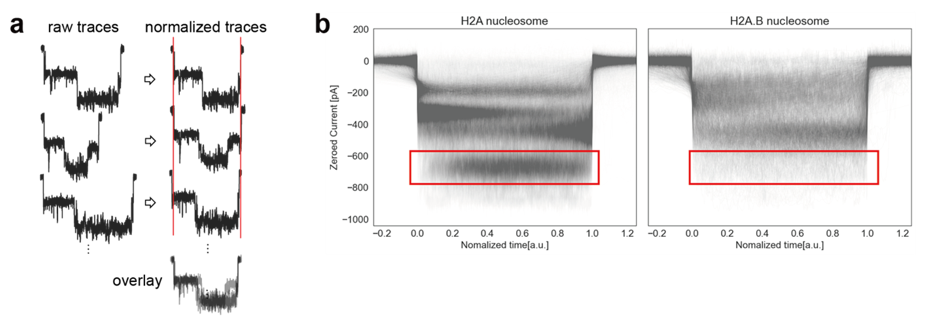
図3:波形の重ね合わせ
波形の重ね合わせのイメージ図(a)と実際に重ね合わせた結果(b)。赤い四角に示されるように、H2A.Bヌクレオソームでは電流値の大きな遮断が少なくなっていることがわかる。bの横軸は規格化した持続時間、縦軸は封鎖電流量である。
以上の結果から、ヌクレオソームがナノポアを通過するときの分子動態のモデルを考案しました。H2Aヌクレオソームは構造安定性が高いため、DNAがゆっくりと巻き戻され、ポアに引き込まれた状態でH2A-H2Bダイマーが露出してポアを塞ぎます。その一方で、H2A.Bヌクレオソームは構造が不安定なため、すばやくヌクレオソームが崩壊し、ポアから遠いところでH2A.B-H2Bダイマーが露出して、DNAから解離していくものと考えられます(図 4)。
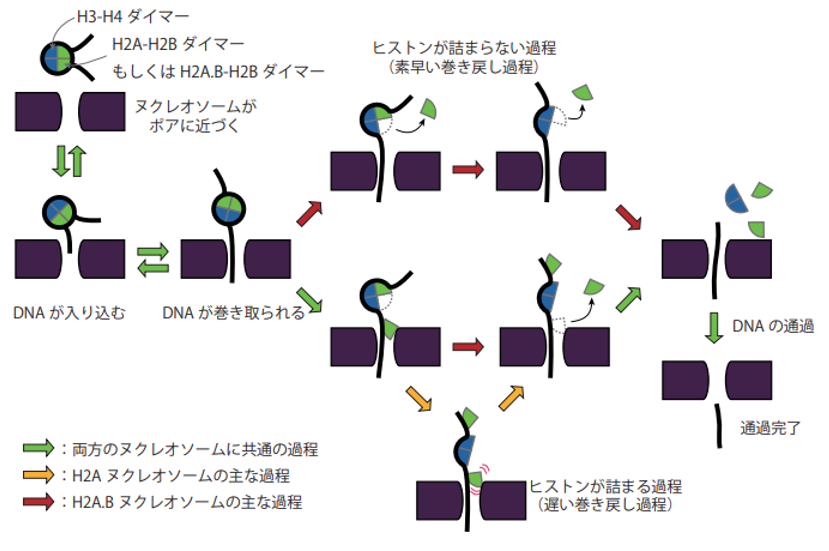
図4:ナノポア通過時のヌクレオソームの中間状態に関するモデル
ナノポア計測では転写時に近い条件を再現しているため、H2A.B-H2BダイマーがDNAから速やかに解離していく過程は転写時でも起こっていると考えられます。そのため、H2A.BはこのようにDNAからスムーズに解離していくことで転写を促進している可能性が示唆されました。
社会的意義・今後の予定
転写時におけるDNAのヒストンからの巻き戻し過程を理解する新しいツールを開発したことによって、将来的に転写制御に関わる詳細な仕組みを応用し、治療薬開発に貢献できる可能性を見出しました。
論文情報
- 雑誌名
Communications Biology論文タイトル
Nucleosomal DNA unwinding pathway through canonical and non-canonical histone disassembly著者
Hikaru Nozawa, Fritz Nagae, Satoshi Ogihara, Rina Hirano, Hirohito Yamazaki, Ryo Iizuka, Munetaka Akatsu, Tomoya Kujirai, Shoji Takada, Hitoshi Kurumizaka and Sotaro Uemura*
(*責任著者)
研究助成
本研究は、日本科学振興機構における戦略的創造研究推進事業CREST「生体環境からの AI 駆動型1分子ナノポア計測法の開発(研究代表者:上村想太郎)」や戦略的創造研究推進事業ERATO「胡桃坂クロマチンアトラスプロジェクト(研究代表者:胡桃坂仁志)」、戦略的創造研究推進事業ERATO「鈴木RNA修飾生命機能プロジェクト(研究代表者:鈴木勉)」及び日本学術振興会における科学研究費助成事業の基盤S「クロマチンにおけるDNA修復機構の構造基盤の解明(研究代表者:胡桃坂仁志)」、学術変革領域研究(A)「エピコードを規定するクロマチンの基盤構造とその動作原理の解明(研究代表者:胡桃坂仁志)」、特別研究員奨励費「ナノポアサーモスコピーによる単一タンパク質の構造エネルギー地形の可視化(研究代表者:山崎洋人)」また、本研究は、AMED「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
用語解説
注1 ソリッドステートナノポア
ナノポアは、ナノm(1mの10億分の1)という超微細なサイズの穴(ポア)のこと。半導体基板などの無機固体に直径がナノメートルスケールの孔のこと。ナノポアの両側を電解質で満たし、電圧を印加することで発生する電流を計測することをナノポア計測と呼ぶ。このとき、電荷を帯びた分子は孔に引き込まれるため、孔を塞ぐことがあり、その時の封鎖信号から分子の形状・大きさ・動態などを検出・識別することができる。
注2 ヒストンバリアント
通常型のヒストンに置き換えられてヌクレオソームを構成するタンパク質。
注3 ヌクレオソーム
DNAとヒストン八量体からなる、染色体を構成する基本単位。ヒストン八量体はH2A-H2B二量体2つと、H3-H4二量体2つから構成され、このヒストン八量体にDNAが巻き付いた構造をとっている。↑
注4 RNAポリメラーゼ
DNAを転写してRNAを合成する酵素の総称。
注5 光ピンセット
レーザー光を利用して微小な物体を非接触で捕捉または操作する技術。
注6 高速AFM(原子間力顕微鏡)
生体分子や細胞の表面を高速でリアルタイムに可視化するための顕微鏡技術。
注7 MDシミュレーション
原子や分子の運動をコンピュータ上で時間発展させることにより、物質の動的挙動や構造的特性を研究する手法。