2024-09-28 理化学研究所,国立精神・神経医療研究センター
理化学研究所(理研)生命医科学研究センター 共生微生物叢研究チームの須田 亙 チームリーダー、増岡 弘晃 研究員と国立精神・神経医療研究センター(NCNP)神経研究所の山村 隆 特任研究部長、免疫研究部の竹脇 大貴 研究員らの共同研究グループは、中枢神経系の自己免疫疾患[1]である多発性硬化症(MS)[2]の重症患者の腸内細菌叢(そう)[3]から、メタゲノム解析[4]を用いることで、MSの進行や難治化に関連する腸内細菌「Tyzzerella nexilis(ティザレラ菌)[5]」を同定し、その中に神経炎症を悪化させる機能があり、特殊なゲノムを持つ株(B株)が存在することを発見しました。
本研究は、日本でも年々増加傾向にあり、難病にも指定されているMSの新たな治療法の開発や創薬につながる成果として期待されます。
ティザレラ菌は健康な人の糞便(ふんべん)中にも存在する常在細菌ですが、ティザレラ菌B株は、他の細菌から「水平遺伝子伝播[6]」によって驚くほど多くの遺伝子を取り込んだ”異型”細菌株と考えられていました。今回調べた範囲では、糞便中でティザレラ菌が増える疾患はMSに限られ、この腸内細菌を標的とする薬剤開発はMSの進行を予防する根本的な戦略につながる可能性があります。
今回の発見は、詳細な臨床情報がひもづいた患者サンプルを基に、理研が持つ高度な細菌叢解析技術とNCNPが持つ確かな実験的検証技術の組み合せに加え、正確な全ゲノム配列を決定できる「ロングリードシークエンス[7]」という最新技術の導入により実現しました。このような手法の活用で、ヒトの腸内細菌研究は、さらに精度の高い解析を目指した新しい時代に入るものと考えられます。
本研究は、科学雑誌『Cell Reports』オンライン版(9月27日付:日本時間9月28日)に掲載されました。
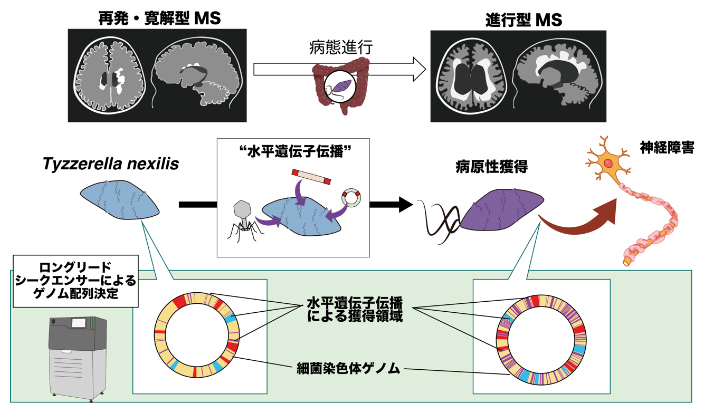
本研究の概念図
背景
近年、免疫が関わるさまざまな脳の疾患への腸内細菌の関与が明らかとなり、この異常を矯正する低コストかつ持続可能な治療の実現を目指す研究への関心が高まっています。脳神経内科の代表的な難病である多発性硬化症(MS)は、脳や脊髄などの中枢神経に対する自己免疫が原因で生じる疾患です。国内患者数は2万人を超え、さらに増加する傾向にありますが、根治療法は確立しておらず若者に襲いかかる神経障害の代表的な原因の一つになっています。
MS患者の多くは症状の悪化と改善を繰り返す再発・寛解型MS(RRMS)として発症し、その一部は神経障害が改善することなく悪化し続けていく二次性進行型MS(SPMS)へと移行します。SPMSに対する治療薬の効果は非常に限定的であり、その新規治療法開発は”満たされていない医療ニーズ”でした。
これまでにNCNPの山村特任研究部長らの研究グループは、MSの動物モデルを用いた検討において、抗菌薬の投与が腸内細菌を変化させることで中枢神経の炎症を軽症化することを報告しており注1)、この研究が発端となって世界中で腸内細菌と脳内炎症の関連を解明しようとする研究が始まりました。その後、山村特任研究部長、須田チームリーダーらは、MS患者の腸内細菌叢が健常者とは大きく異なることを報告し注2)、さらにMSの進行に伴い腸内細菌叢の機能が大きく変化することを初めて明らかにしました注3)。しかし、治療の標的となるMSの進行において決定的に重要な腸内細菌を見つけられていませんでした。
今回、共同研究グループは、腸内細菌叢に存在する多種多様な細菌を網羅的かつ詳細に解析できるメタゲノム解析を用いて、SPMSの病態に関わる腸内細菌の特定に取り組みました。
注1)Yokote, H. et al. NKT cell-dependent amelioration of a mouse model of multiple sclerosis by altering gut flora. Am J Pathol173, 1714-1723. 2008.
注2)Miyake S. et al. Dysbiosis in the Gut Microbiota of Patients with Multiple Sclerosis, with a Striking Depletion of Species Belonging to Clostridia XIVa and IV Clusters. PLoS One. 2015.
注3)Takewaki D. et al. Alterations of the gut ecological and functional microenvironment in different stages of multiple sclerosis. PNAS. Vol.117. No.36. 2020.
研究手法と成果
共同研究グループは、MSを悪化させる細菌の候補を見つけるために、29人の健常者、NCNP病院に通院中の62人のRRMS患者、15人のSPMS患者の腸内細菌叢をメタゲノム解析により調べました(図1)。
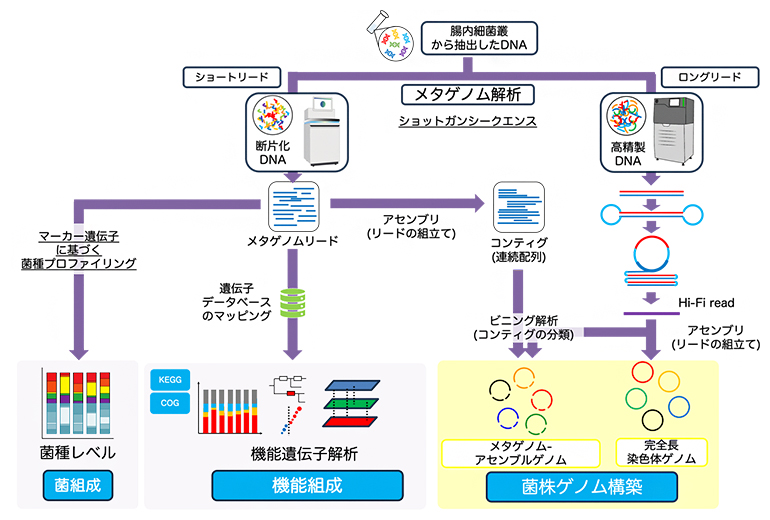
図1 メタゲノム解析の概略
糞便検体から調製した菌叢全体のDNAに対し、高速シークエンサーを用いたショットガンシークエンスを行う。得られたデータを用いてデータベースの検索による菌組成の計算や、アセンブルと呼ばれる技術による個々の細菌のゲノム再構築などを行う。
その結果、SPMS患者の腸内細菌叢で最も特徴的な菌種としてティザレラ菌(Tyzzerella nexilis)を発見しました(図2A)。さらに腸内細菌叢の中にティザレラ菌が多い患者ほど、脳のMRI画像から計算される脳萎縮の程度が大きく、神経障害が強い傾向があることが分かり、ティザレラ菌はMSの難治化と密接に関連する菌種であると考えられました。
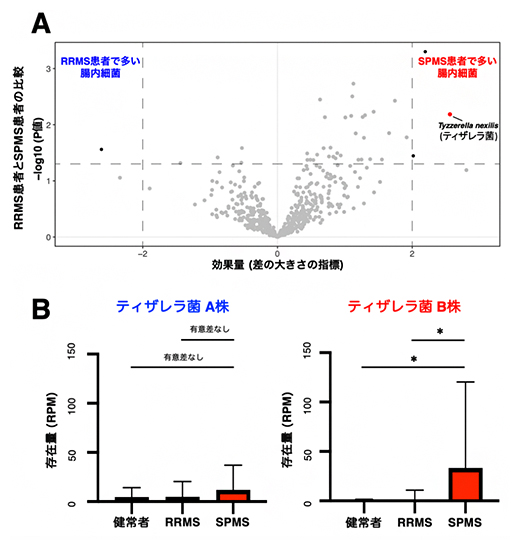
図2 SPMS患者の腸内細菌叢において特徴的な腸内細菌
(A)細菌のマーカー遺伝子を基にプロファイリングした菌種組成データを統計学的に解析したところ、SPMS患者に特徴的な菌種としてティザレラ菌(Tyzzerella nexilis)を同定した。
(B)健常者、RRMS患者、SPMS患者の腸内細菌叢の中にあるティザレラ菌A株とB株の存在量を比較した。その結果、A株は健常者、RRMS患者とSPMS患者の間に分布の違いがなかったが、B株はSPMS患者でのみ顕著に多く存在することが明らかになった。(*:P<0.05)
それぞれの菌種にはゲノムDNAの配列が異なる複数の菌株が実際には含まれていると考えられます。しかし、これまでは技術的な理由で腸内細菌の研究は主に菌種という分類を基に行わざるを得ませんでした。本研究では、ビニング[8]という手法を用いて解析を進めたところ、ティザレラ菌にはゲノム構造が大きく異なるA株とB株が存在し、二つの菌株の分布がMSの病型によって異なっていました。A株は健常者、RRMS患者とSPMS患者の間に分布の違いがありませんでしたが、B株はSPMS患者でのみ顕著に多く存在する特殊な株であることが分かりました(図2B)。私たちはこのA株とB株の違いに注目し、SPMS患者で特に増加するB株に焦点を当てた研究を進めました。
次に、全ゲノム配列を正確に決定できる最先端のロングリードシークエンスという技術を用いて、A株とB株のそれぞれの全ゲノム配列を構築しました。解析を進める中で、MSの進行に関連するティザレラ菌B株は、「水平遺伝子伝播」と呼ばれる、進化とは異なる遺伝子獲得機構によって驚くほど多くの遺伝子を獲得し、極めてまれなゲノム構造を持つ”異型”細菌株であると考えられました(図3)。そこで、このような”異型”の腸内細菌がなぜSPMSで増加しているのか、B株が持つ機能の解析を進めました。
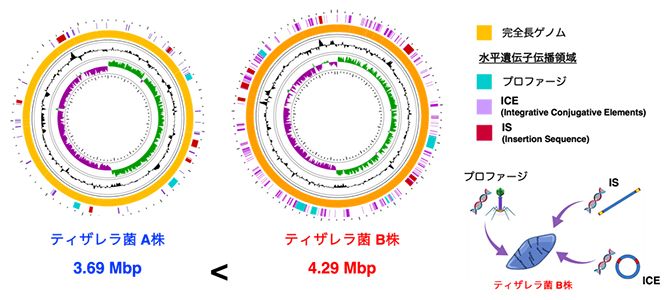
図3 ティザレラ菌B株が持つ特殊なゲノム構造
ロングリードシークエンサーを用いることで、ティザレラ菌のうち、ゲノム構造が異なる2株の完全長ゲノムを構築した。ティザレラ菌B株のゲノム上には水平遺伝子伝播によって獲得したと推測されるゲノム領域が多く存在することが明らかになった。Mbp:Mは100万、bpは塩基対を表す。
B株のゲノム上の水平遺伝子伝播によって得られたと推測された領域には特徴的な機能に関連する遺伝子として、硫酸還元[9]に関する遺伝子と鞭毛[10]に関する遺伝子が見つかりました。一般的に硫酸還元菌は硫化水素を産生し、周囲の環境を還元することで酸化ストレスに対する耐性を持つことが知られています。このことからB株は、酸化ストレスによって常在菌が破壊されるような過酷な環境の中でも生き残るすべを身に付けているということができます。また、B株だけが鞭毛を持っていることが電子顕微鏡により明らかになり、B株の鞭毛は、大腸において炎症を誘導するT helper 17(Th17)細胞[11]を活性化させる機能があり、病気を悪化させる方向に働くことが分かりました(図4)。
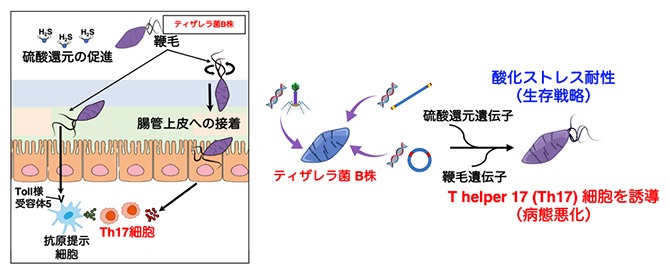
図4 ティザレラ菌B株が持つ機能的特徴
ティザレラ菌B株が水平遺伝子伝播によって獲得したと推定される鞭毛は、腸管の抗原提示細胞上のToll様受容体(病原体に特有の分子パターンを認識する受容体の一種)5への刺激と、腸管上皮への接着の促進を介して、炎症を誘導するTh17細胞を活性化する。
最後に、いかなる細菌も腸内に存在しない無菌マウスにA株またはB株を単独で定着させることで、A株のみを持ったノトバイオートマウス[12]、B株のみを持ったノトバイオートマウスを作製しました。これらのマウスに、MSのモデルとして使用されている実験的自己免疫性脳脊髄炎(EAE)[13]を誘導する処置を施し、マウスに生じた神経障害の強さを比較しました。その結果、B株を定着させたマウスでは、神経障害が強くなることを示しました(図5)。これによって、ティザレラ菌B株がヒトのMSに対しても高い病原性を獲得していることが強く示唆されました。
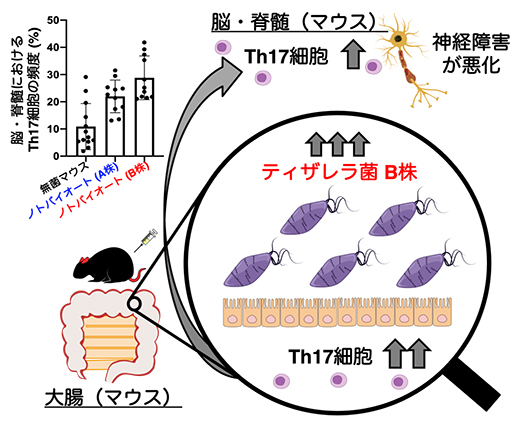
図5 「ティザレラ菌B株」が神経炎症に与える影響
MSの動物モデルであるEAEを用いた実験によって、ティザレラ菌B株を定着させたノトバイオートマウスでは、脳・脊髄と大腸において炎症を誘導するTh17細胞が増加し、マウスの神経障害が悪化することが明らかになった。
このように、MSの進行に関連する菌株(ティザレラ菌B株)が生まれる過程において「水平遺伝子伝播」による遺伝子の獲得が生じ、その結果B株はMS患者の腸管の中で生き残るすべを獲得したということができます。その一方で、B株は炎症を誘導して病気を悪化させるような機能も併せ持つようになり、MSの病態に能動的に関わるようになったと考えられました。
今後の期待
本研究は、NCNP免疫研究部と理研生命医科学研究センター共生微生物叢研究チームがそれぞれの強みを生かし、さらにロングリードシークエンスという最先端の技術を導入したことによって実現しました。その結果、MSの難治化に関連する”異型”腸内細菌株(ティザレラ菌B株)を発見しました。これまで細菌の名前である種名が重要視されてきた腸内細菌叢研究において、「同じ種名を持っているにもかかわらず、疾患との関連性が異なる細菌が存在すること」を発見した本研究は、腸内細菌叢研究に一石を投じる研究となることが期待されます。
常在細菌が水平遺伝子伝播によって獲得した病原性が、ヒトの慢性疾患に影響を与えることについての報告は世界初であり、今後さまざまな疾患で同様の腸内細菌が見つかる可能性が十分に考えられます。
さらに、MSの進行に関連する菌株(B株)は現在のところ有力な治療法に乏しいSPMSにおける創薬シーズとも期待されます。「難病」として知られてきたMSを腸内細菌の制御によって根治に導く時代の到来が期待されます。
補足説明
1.自己免疫疾患
通常、異物である細菌やウイルスを排除するために働く免疫システムが、自分自身の正常な細胞や組織に対してまで過剰に反応し攻撃してしまう自己免疫と呼ばれる現象によって引き起こされる疾患。
2.多発性硬化症(MS)
中枢神経(脳や脊髄)に炎症が生じ、運動・感覚・視力などのさまざまな身体機能が障害される自己免疫疾患。若年で発症し、再発と寛解を繰り返しながら生涯にわたり徐々に障害が蓄積していくことが知られている。MSはMultiple Sclerosisの略。
3.腸内細菌叢(そう)
ヒトを含む動物の腸管内には多種多様な細菌が存在しており、これを腸内細菌と呼んでいる。腸内細菌は互いに作用し合うことで複雑な生態系を形成しており、この細菌群集を腸内細菌叢と呼ぶ。
4.メタゲノム解析
ショットガンシークエンス法によって取得したサンプルDNA中に含まれる細菌のゲノム情報を網羅的に解析する腸内細菌叢解析手法。最新のメタゲノム解析では、既存のデータベースを介さずに独自のデータのみから細菌ゲノムの再構築を行うことも可能となった。サンプルから抽出したDNAを物理的に断片化し、高速シークエンサーを用いて、サンプル中の遺伝情報を網羅的に読み取る手法のことをショットガンシークエンス法と呼ぶ。
5.Tyzzerella nexilis(ティザレラ菌)
Bacillota門、Clostridiaceae科に含まれる腸内常在にする細菌の一種。米国国立バイオテクノロジー情報センター(NCBI)の分類学(taxonomy)データベースでは、[Clostridium] nexileとして表記されている。
6.水平遺伝子伝播
遺伝子伝播は、世代を超えて伝播する垂直伝播以外に、種を超えて伝播する水平伝播というメカニズムが存在する。例えば、腸管出血性大腸菌の毒素産生性遺伝子は赤痢菌から水平伝播することによって取り込まれたと推測されている。
7.ロングリードシークエンス
従来の高速シークエンサーは1リードの読み取り長が150bp(塩基対)ほどであり、数百万塩基対ある腸内細菌のゲノムを不完全に断片化した状態でしか再構築できない問題があった。近年では、読み取り長が1万塩基対以上に改善された高速シークエンサー(ロングリードシークエンサー)が登場し、細菌のゲノムを完全に再構築することが可能になった。
8.ビニング
メタゲノムデータの中に含まれる大量の配列から、同じ菌種に由来する配列を計算的に分類し、各細菌のゲノムを推定し再構築する手法。
9.硫酸還元
特定の細菌が、硫酸を最終電子受容体として、硫化水素へと還元する仕組み。
10.鞭毛
細菌の中には遊泳運動を行うために鞭毛と呼ばれる運動器官を持つ種類が存在している。また、宿主の細胞との接着に大きく影響することが知られている。
11.T helper 17(Th17)細胞
白血球の一種であるヘルパーT細胞のサブセットの一つであり、サイトカインであるインターロイキン17を産生する。組織で炎症を誘導する能力を持ち、自己免疫疾患の病態に密接に関連していると考えられている。
12.ノトバイオートマウス
腸内細菌などの常在細菌を持たない無菌マウスに、特定の微生物のみを定着させたマウス。ノトバイオートマウスは特定の微生物の宿主への影響を解析する際にも必要不可欠である。
13.実験的自己免疫性脳脊髄炎(EAE)
中枢神経組織由来のタンパク質抗原などをマウスに投与することで実験的に誘導できる自己免疫性疾患のモデルであり、生じる神経症状が多発性硬化症(MS)と類似することから、MSの疾患モデルとして広く利用されている。EAEはExperimental Autoimmune Encephalomyelitisの略。
共同研究グループ
理化学研究所 生命医科学研究センター
共生微生物叢研究チーム
チームリーダー 須田 亙(スダ・ワタル)
研究員 増岡 弘晃(マスオカ・ヒロアキ)
特別研究員 黒川 李奈(クロカワ・リナ)
粘膜免疫研究チーム
上級研究員 成島 聖子(ナルシマ・セイコ)
国立精神・神経医療研究センター 神経研究所
特任研究部長 山村 隆(ヤマムラ・タカシ)
免疫研究部
室長 佐藤 和貴郎(サトウ・ワキロウ)
研究員 竹脇 大貴(タケワキ・ダイキ)
(理研 生命医科学研究センター 共生微生物叢研究チーム 客員研究員)
研究員 ベンジャミン・ジョーゼフ・エドワード・レイバニー(Benjamin J. E. Raveney)
(理研 生命医科学研究センター 共生微生物叢研究チーム 客員研究員)
研究員 マラハリ・マヌ(Mallahalli Manu)
疾病研究第五部
部長 荒木 敏之(アラキ・トシユキ)
室長 栁下 聡介(ヤギシタ・ソウスケ)
国立精神・神経医療研究センター病院
放射線診療部
部長 佐藤 典子(サトウ・ノリコ)
医長 木村 有喜男(キムラ・ユキオ)
東京大学 大学院 新領域創成科学研究科
特任助教 木口 悠也(キグチ・ユウヤ)
(理研 生命医科学研究センター 共生微生物叢研究チーム 客員研究員)
順天堂大学 免疫学講座
教授 三宅 幸子(ミヤケ・サチコ)
研究支援
本研究は、発酵研究所大型研究助成「日本人腸内細菌種を宿主とするファージの同定と分離(研究代表者:須田亙)」、AMED-CREST研究開発領域「微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発症のメカニズム解明」の研究開発課題「腸内細菌叢を介した神経炎症・変性・神経発達障害の修飾機序に関する研究(研究開発代表者:山村隆)」、ヤクルト研究財団特別研究助成「多発性硬化症の進行に関連する病原性腸内細菌が神経炎症・神経変性を引き起こす機序の解明(研究代表者:竹脇大貴)」を受けて行われました。また、ロングリードシークエンサーを用いたシークエンス解析は、理研生命医科学研究センターのゲノムプラットフォームの支援により実施し、走査型電子顕微鏡による解析は、理研生命医科学研究センターのイメージング・顕微鏡プラットフォームの支援により実施しました。
原論文情報
Daiki Takewaki*, Yuya Kiguchi*, Hiroaki Masuoka, Mallahalli Manu, Ben J E Raveney, Seiko Narushima, Rina Kurokawa, Yusuke Ogata, Yukio Kimura, Noriko Sato, Yusuke Ozawa, Sosuke Yagishita, Toshiyuki Araki, Sachiko Miyake, Wakiro Sato, Wataru Suda†, Takashi Yamamura†, “Tyzzerella nexilis strains enriched in mobile genetic elements are involved in progressive multiple sclerosis”, Cell Reports, 10.1016/j.celrep.2024.114785
発表者
理化学研究所
生命医科学研究センター 共生微生物叢研究チーム
チームリーダー 須田 亙(スダ・ワタル)
研究員 増岡 弘晃(マスオカ・ヒロアキ)
国立精神・神経医療研究センター 神経研究所
特任研究部長 山村 隆(ヤマムラ・タカシ)
免疫研究部
研究員 竹脇 大貴(タケワキ・ダイキ)
報道担当
理化学研究所 広報室 報道担当
国立精神・神経医療研究センター 総務課広報室