2024-11-01 理化学研究所,香川大学
理化学研究所(理研)生命医科学研究センター 免疫細胞治療研究チームの藤井 眞一郎 チームリーダー(最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクター・プロジェクトリーダー)、香川大学 医学部 血液・免疫・呼吸器内科学の門脇 則光 教授(香川大学医学部附属病院 病院長)らの共同研究チームは、新型コロナウイルス感染症(COVID-19)[1]高リスク群であるB細胞悪性腫瘍[2]患者を対象とした新規のCOVID-19ワクチン、aAVC-CoV-2の医師主導型第Ⅰ相治験[3]を今年中に開始する予定です。
本治験では、従来のCOVID-19 mRNAワクチンでは抗体産生が十分に誘導できないワクチン接種者に対し、T細胞[4]免疫を誘導することで、新型コロナウイルス(SARS-CoV-2)[5]に対する感染防御効果の実証が期待されます。
藤井チームリーダーらは、がんや感染症に対して自然免疫[6]と獲得免疫[6]を賦活化する「人工アジュバントベクター細胞(aAVC:エーベック)[7]ワクチン」を独自に開発し、研究を進めてきました注1)。今回、共同研究チームはCOVID-19に対する新規ワクチンとして、SARS-CoV-2のスパイクタンパク質を搭載した「aAVC-CoV-2」を開発しました。これまでの非臨床試験では、aAVC-CoV-2による高いスパイクタンパク質特異的T細胞応答や抗体産生が報告されており注2)、感染予防試験でも良好な結果が得られています。この結果を踏まえ、香川大学と共同でaAVC-CoV-2の医師主導型第Ⅰ相治験を実施し、ヒトにおける安全性および免疫学的有効性のエビデンスを得ることを目指します。
背景・治験のポイント
現行のSARS-CoV-2スパイクタンパク質をコードするCOVID-19 mRNAワクチンは、中和抗体の誘導を目的とし、多くの健常者に感染防御を成立させ、世界的なSARS-CoV-2によるパンデミックの抑制に貢献しました。しかしながら、パンデミック期間中、感染高リスク群、特に造血器腫瘍患者においては、ワクチンによる抗体産生が低く、感染後の重症化率や致死率が高いことが判明しました注3)。現在、COVID-19の感染者数や重症化率は落ち着いているものの、依然として抗原性の変化した新たなSARS-CoV-2変異株が次々と出現しています。今後も、感染伝播(でんぱ)性の高いウイルスの出現や、重症化のリスクが高い感染高リスク群における感染の懸念が続くことが予想されます。
特に、B細胞悪性腫瘍(B細胞性リンパ腫、多発性骨髄腫など)や化学療法後の急性骨髄性白血病[8]患者のような易感染性の高いリスク群がCOVID-19に罹患(りかん)した場合、ウイルスを排除できず感染が持続することがあり、その結果、原疾患の治療が進まない、あるいは退院できないという臨床現場からの報告も数多くあります注4)。また、易感染性の高いリスク群は、感染を繰り返したり、感染が長引いたりすることにより、体内で新たな変異株が生じる可能性があり、この新たな変異株は易感染性の高いリスク群以外の人々にとっても脅威となるかもしれません。そのため、現行のワクチンが効きづらい人に対する新たなワクチンの開発が強く求められています。
抗ウイルス免疫において、CD8陽性T細胞[4]は感染細胞上の主要組織適合遺伝子複合体(MHC)[9]に提示されたウイルス抗原を認識し、キラーT細胞[4]となり、ウイルス抗原を殺傷することでウイルスの増幅や潜伏感染を防ぎ、重症化を抑える役割を果たします。COVID-19パンデミック時には、造血器腫瘍の症例において、CD8陽性T細胞の数が少ない群は、多い群に比べて感染後の死亡数が多くなり、CD8陽性T細胞数は最も予後と相関しているとの報告もありました注5)。また、抗体とキラーT細胞は誘導されるエピトープ[10]が異なるため、ウイルスが変異して抗体が誘導されなくてもキラーT細胞が誘導される可能性があり、変異株に対しても効果が期待されます。
免疫細胞治療研究チームは、がんや感染症に対する免疫療法としてaAVCワクチンを独自に開発してきました注6)。aAVCはワクチンシステムで、自然免疫リンパ球であるナチュラルキラーT(NKT)細胞[11]の活性化をトリガーとして、体内の樹状細胞[12]の成熟化を促進し、自然免疫と獲得免疫の両方を賦活化できるワクチンプラットフォーム技術です。aAVCは、細胞表面上にNKT細胞を活性化する糖脂質であるアルファガラクシトシルセラミド(α-GalCer)とCD1d分子の複合体を、対象となる病気のがん抗原またはウイルス抗原タンパク質を細胞内に発現した細胞です。
CD1dタンパク質を介してaAVCに付着した糖脂質がNKT細胞を活性化させて、aAVC自体は体内で破壊されて樹状細胞に取り込まれます。この一連の反応により、樹状細胞の機能が最大限に強化され、ワクチンとして作用します(図1)。すでに、再発・治療抵抗性の急性骨髄性白血病患者に対して、WT1[13]抗原を発現したaAVC-WT1の医師主導型第Ⅰ相治験を行い、ヒトにおける安全性と、自然免疫および獲得免疫の両方における免疫学的効果、また一定の治療効果を確認しています注6)。
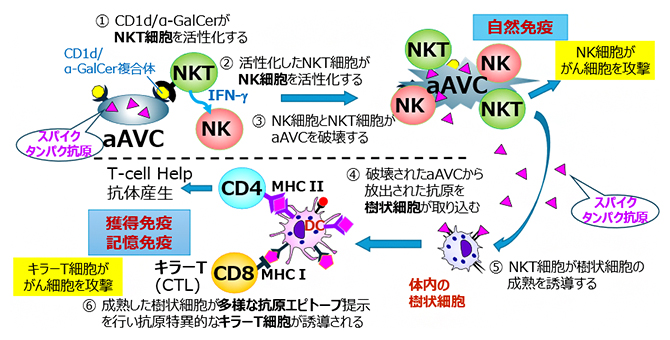
図1 aAVCの作用機序
CD1dタンパク質を介してaAVCに付着した糖脂質(α-GalCer)がNKT細胞を活性化させる。aAVC自体は体内でNK細胞とNKT細胞に破壊されて樹状細胞に取り込まれ、NKT細胞が樹状細胞の成熟を誘導する。その樹状細胞がCD4陽性T細胞およびCD8陽性T細胞を効率的に誘導する。IFN-γはⅡ型インターフェロン。
また、SARS-CoV-2のスパイクタンパク質を搭載したaAVC-CoV-2を開発し、非臨床安全性試験[14]で安全性を確認し、非臨床薬理薬効試験[14]においてスパイクタンパク質特異的CD4陽性およびCD8陽性T細胞が肺、脾臓(ひぞう)で高率に誘導されること、またそれがメモリーT細胞[15]として維持されることを報告しました注7)。
これらの非臨床試験を基に、ヒトにおける薬物の有効性の概念実証を得るための臨床治験を目指し、2023年11月からはAMED-SCARDA ワクチン・新規モダリティ研究開発事業に採択され、「多機能性免疫誘導を有する新規ワクチンモデリティ『人工アジュバントベクター細胞(aAVC)』技術による感染症ワクチンの開発」として、治験に向けた準備を進めていました。
本プロジェクトは、理研免疫細胞治療研究チームの藤井チームリーダーを中心に、東京大学医科学研究所TR・治験センターの長村文孝教授、日本医科大学医学部医療管理学の松山琴音特任教授、国立感染症研究所の福士秀悦室長、日本赤十字社医療センター骨髄腫アミロイド―シスセンターの鈴木憲史顧問の支援を受け、香川大学医学部血液・免疫・呼吸器内科学の門脇教授(香川大学医学部附属病院病院長)らが主導し、医師主導型第Ⅰ相治験を実施する予定です。
医師主導型第Ⅰ相治験のポイント
- aAVCは、単回投与で自然免疫と獲得免疫を誘導し、さらには1年以上持続する記憶免疫[16]も引き出す「多機能性がんワクチンシステム」として開発されました。このシステムの特徴は、放射線照射を施した他家細胞を用いることにより細胞治療薬として大量に安定した品質で製造・保管することが可能であり、誰にでも使用可能な点にあります。
- 今回の医師主導第Ⅰ相治験では、B細胞悪性腫瘍を対象として、SARS-CoV-2のスパイクタンパク質に着目して開発されたaAVC-CoV-2の治験を実施します。将来的には、対象疾患の拡大が期待されます。また、aAVCはワクチンシステムであるため、他のウイルス抗原を発現したaAVCの開発も可能です。
- 香川大学医学部附属病院は、これまでaAVCの開発支援を行ってきた経緯から、同病院において医師主導型第Ⅰ相治験を実施することが決定しました。
注1)Fujii S et al. Antigen mRNA-transfected, allogeneic fibroblasts loaded with NKT-cell ligand confer antitumor immunity. Blood. 2009. 113:4262-72.
Shimizu K et al. Vaccination with antigen-transfected, NKT cell ligand-loaded, human cells elicits robust in situ immune responses by dendritic cells. Cancer Res. 2013. 73:62-73.
Shimizu K et al. Systemic DC activation modulates the tumor microenvironment and shapes the long-lived tumor-specific memory mediated by CD8+ T cells. Cancer Res. 2016, 76:3756-66.
Yamasaki S et al. In vivo dendritic cell targeting cellular vaccine induces CD4+ Tfh cell-dependent antibody against influenza virus. Sci Rep. 2016, 6:35173.
Fujii S et al. Cancer immunotherapy using artificial adjuvant vector cells to deliver NY-ESO-1 antigen to dendritic cells in situ. Cancer Sci. 2022, 113:864.
Fujii S et al. Reinvigoration of innate and adaptive immunity via therapeutic cellular vaccine for patients with AML. Molecular Therapy Oncolytics. 2022, 27:315-332.
Shimizu K et al. Combination of cancer vaccine with CD122-biased IL-2/anti-IL-2 Ab complex shapes the stem-like effector NK and CD8+ T cells against tumor. J Immunother Cancer. 2023, 11(7):e006409.
Yamasaki S et al. Tumor epitope spreading by a novel multivalent therapeutic cellular vaccine targeting cancer antigens to invariant NKT-triggered dendritic cells in situ. Front Immunol. 2024, 15:1345037.
注2)Shimizu K et al. A single immunization with cellular vaccine confers dual protection against SARS-CoV-2 and cancer. Cancer Sci. 2022, 113(8):2536-2547.
注3)Ribas A et al. How to Provide the Needed Protection from COVID-19 to Patients with Hematologic Malignancies. Blood Cancer Discov. 2021, 2(6):562.
Salmanton-Garcia J et al. Decoding the historical tale: COVID-19 impact on haematological malignancy patients-EPICOVIDEHA insights from 2020 to 2022. EClinicalMedicine 2024, 71:102553
注4)Lee CY et al. Prolonged SARS-CoV-2 Infection in Patients with Lymphoid Malignancies. Cancer Discov. 2022, 12(1):62.
注5)Bange EM et al. CD8+ T cells contribute to survival in patients with COVID-19 and hematologic cancer. Nat Med. 2021, 27(7):1280.
注6)Fujii S et al. Immune Networks and Therapeutic Targeting of iNKT Cells in Cancer. Trends Immunol. 2019, 40: 984
Fujii S et al. NKT-licensed in vivo dendritic cell-based immunotherapy as cellular immunodrugs for cancer treatment. Crit Rev Oncogenesis. 2024, 29(1):45.
注7)Fujii S et al. Reinvigoration of innate and adaptive immunity via therapeutic cellular vaccine for patients with AML. Mol Ther Oncolytics. 2022, 27:315.
今後の期待
本研究において開発されたaAVC-CoV-2が将来的に製剤として認可された場合、抗体を誘導できないB細胞悪性腫瘍患者のみならず、従来のワクチンでは十分な防御機能を得られない免疫の低下した人に対する有効な対策となることが期待されます。
補足説明
1.新型コロナウイルス感染症(COVID-19)
新興感染症で、SARS-CoV-2([5]参照)の感染によって引き起こされる。
2.B細胞悪性腫瘍
Bリンパ球が成熟する過程で生じる悪性腫瘍。
3.医師主導型第Ⅰ相治験
医師主導治験とは、医師自らが治験を企画・立案し、治験届を提出し治験を実施するもの。臨床試験のうち第Ⅰ相治験の目的は、主に治験薬の安全性および薬物の体内動態、薬剤の最大用量を確認することである。
4.T細胞、CD8陽性T細胞、キラーT細胞
T細胞は胸腺という組織で分化、成熟したリンパ球の一種。獲得免疫をつかさどり、抗原提示細胞から抗原情報を受け取ることで、さまざまな機能を発揮する。T細胞の中で、CD8陽性T細胞は細胞表面にCD8と呼ばれる特徴的なタンパク質を発現するもので、活性化するとキラーT細胞に分化し、ウイルス感染細胞やがん細胞を殺傷する役割を果たす。
5.新型コロナウイルス(SARS-CoV-2)
2019年12月末に中国武漢で発生した新型肺炎の原因ウイルス。SARS(重症急性呼吸器症候群)を引き起こすウイルス(SARS-CoV)の姉妹種であるとして「SARS-CoV-2」と名付けられた。疾患名はCOVID-19([1]参照)。
6.自然免疫、獲得免疫
自然免疫は先天的な免疫システムで、さまざまな種類の抗原を対象に初期防衛を担い、獲得免疫は、抗体や多様な細胞性免疫応答によって特定の異物を認識し排除する。
7.人工アジュバントベクター細胞(aAVC:エーベック)
がんの免疫療法で研究が進められている人工細胞。他家細胞(マウス用にはNIH3T3細胞、ヒト用にはHEK293細胞)に、CD1d分子のmRNAと標的抗原分子のmRNAを遺伝子導入させ、CD1d上にアルファガラクシトシルセラミド(α-GalCer)を発現させた細胞。α-GalCerはNKT細胞を活性化させる糖脂質。アジュバントとは免疫反応を増幅させるもの、ベクターは運び屋という意味。aAVCはartificial Adjuvant Vector Cellsの略。
8.急性骨髄性白血病
骨髄の中の未熟な細胞(幼若骨髄系細胞)ががん化・増殖し、骨髄を占拠することにより、正常な血液細胞が作られなくなり、貧血症状、出血、感染による症状が現れる疾患。通常は化学療法や移植治療が行われる。
9.主要組織適合遺伝子複合体(MHC)
ヒトの細胞表面に存在する糖タンパク質で、細胞内で処理した抗原(細菌やウイルスなど身体にとって異物と見なされたものの断片)をのせ、T細胞などの免疫担当細胞に対して抗原提示を行う。この抗原提示により免疫担当細胞が活性化して免疫応答が誘導される。MHCをコードする遺伝子領域をMHC領域と呼ぶ。
10.エピトープ
T細胞、B細胞などが抗原と結合する際には、抗原全体を認識するのではなく、抗原の比較的小さな部位を認識して結合する。この部位をエピトープ(抗原決定基)と呼び、6~10個のアミノ酸や5~8個の単糖の配列から成る。
11.ナチュラルキラーT(NKT)細胞
自然免疫リンパ球の一種。NKT細胞は、NK細胞のマーカーと1種類のT細胞受容体を発現していて、アレルギー疾患、がん、自己免疫疾患を制御する機能を持つ中核的な免疫調節細胞である。
12.樹状細胞
樹状細胞は樹状突起を持つ白血球。未感作(みかんさ)T細胞に異物の情報を伝える細胞(抗原提示細胞)として働き、免疫反応の本質的な司令塔としての役割を担っている。
13.WT1
WT1遺伝子は、小児の腎悪性腫瘍の一つであるWilms腫瘍の発生と関連している遺伝子であり、それによりコードされているWT1タンパク質はさまざまな増殖関連遺伝子の転写を調節している。急性骨髄性白血病をはじめ、さまざまな腫瘍に発現が認められる。
14.非臨床安全性試験、非臨床薬理薬効試験
非臨床安全性試験は、動物実験などを用いて薬剤が人体に有害な影響を与えないかを評価する試験。非臨床薬理薬効試験は、細胞や動物モデルを使用して薬剤の効果や作用メカニズムを確認する試験。これらの試験は、新薬の開発過程で人での臨床試験を始める前に実施され、医薬品の安全性と有効性を確認する重要な役割を果たす。
15.メモリーT細胞
T細胞は、獲得免疫システムの中核を成す細胞で、血液中や組織の中などに存在する。細胞表面に存在する分子によって大きくCD4陽性T細胞とCD8陽性T細胞の2種類に分類される。CD4陽性T細胞は、抗原を認識すると他の免疫細胞を活性化するなどの機能を持ち、CD4陽性ヘルパーT細胞とも呼ばれる。一方、CD8陽性T細胞は、他の細胞を直接殺傷する機能を持つため、CD8陽性キラーT細胞とも呼ばれる。抗原に感作(かんさ)されたT細胞は増殖し活性化した後、一部は記憶免疫化し、次に抗原にさらされた場合に素早く反応する機能を獲得する。これをメモリーT細胞と呼ぶ。
16.記憶免疫
免疫反応の一種で、特定の抗原に対する抗体の構造が保持されており、2回目の抗原の侵入に対して強い免疫応答を起こすことができる。
共同研究グループ
理化学研究所 生命医科学研究センター 免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(aAVC創薬橋渡し基盤ユニット 基盤ユニットリーダー、最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクタ―・プロジェクトリーダー)
香川大学 医学部 血液・免疫・呼吸器内科学
教授 門脇 則光(カドワキ・ノリミツ)
(香川大学医学部附属病院 病院長)
研究支援
本研究は、理研(DMP)により実施し、日本医療研究開発機構(AMED)内の先進的研究開発戦略センター(Strategic Center of Biomedical Advanced Vaccine Research and Development for Preparedness and Response : SCARDA)(AMED-SCARDA)におけるワクチン・新規モダリティ研究開発事業「多機能性免疫誘導を有する新規ワクチンモデリティ「人工アジュバントベクター細胞(aAVC)」技術による感染症ワクチンの開発(研究代表者:藤井眞一郎)」の助成を受けました。
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
チームリーダー 藤井眞一郎(フジイ・シンイチロウ)
(最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクタ―・プロジェクトリーダー)
香川大学 医学部 血液・免疫・呼吸器内科学
教授 門脇 則光(カドワキ・ノリミツ)
(香川大学医学部附属病院 病院長)
報道担当
理化学研究所 広報室 報道担当