2025-02-27 京都大学
秋⼭芳展 医⽣物学研究所教授、檜作洋平 同助教、清⽔洋祐 同博⼠前期課程学生、禾晃和 横浜市立大学准教授らの研究チームは、大阪大学蛋白質研究所、東北大学大学院医学系研究科と共同で、細胞膜の中で働く特殊なタンパク質分解酵素RsePが基質となるタンパク質を結合した状態の立体構造を明らかにしました。本研究により、RsePの内部に取り込まれた基質タンパク質は、しっかりと固定(ヘッドロック)され、引き伸ばされた状態で切断されることが明らかになりました。切断の仕組みを詳しく調べていくことで、将来的には、細菌の感染や増殖を抑える薬剤の開発につながることが期待されます。
本研究成果は、2025年2月26日に、国際学術誌「Science Advances」に掲載されました。
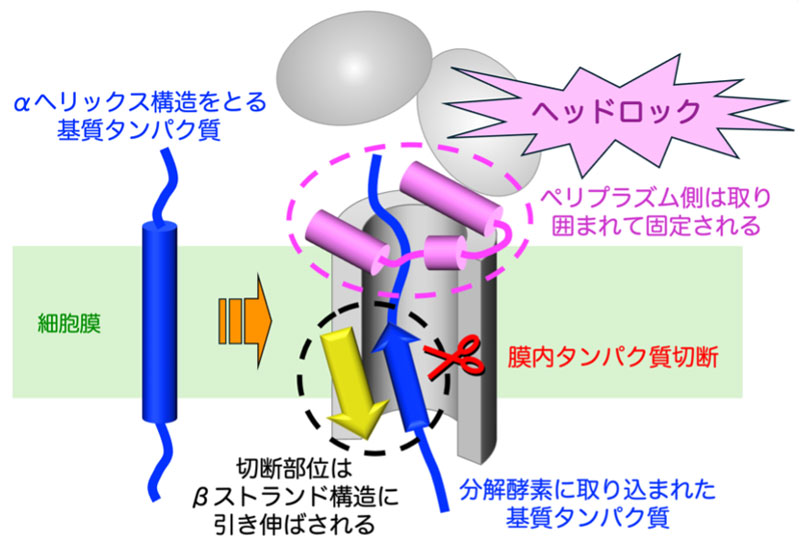 膜内タンパク質分解酵素RsePの基質結合様式:基質となるタンパク質は、RsePに取り込まれる前は、切断されにくいαヘリックス構造をとっている。クライオ電子顕微鏡単粒子解析で決定した複合体構造では、RseP内部に取り込まれた基質タンパク質のペリプラズム側は、ヘッドロックされるように、U字型の領域に取り囲まれている。一方、切断部位は、切断されやすいβストランド構造に引き伸ばされている。
膜内タンパク質分解酵素RsePの基質結合様式:基質となるタンパク質は、RsePに取り込まれる前は、切断されにくいαヘリックス構造をとっている。クライオ電子顕微鏡単粒子解析で決定した複合体構造では、RseP内部に取り込まれた基質タンパク質のペリプラズム側は、ヘッドロックされるように、U字型の領域に取り囲まれている。一方、切断部位は、切断されやすいβストランド構造に引き伸ばされている。
詳しい研究内容について
分解酵素は細胞膜の中でタンパク質をヘッドロックして切断する〜基質と結合した膜内タンパク質分解酵素の立体構造を解明〜
研究者情報
研究者名:秋山 芳展
研究者名:檜作 洋平
書誌情報
【DOI】https://doi.org/10.1126/sciadv.adu0925
【書誌情報】
Kikuko Asahi, Mika Hirose, Rie Aruga, Yosuke Shimizu, Michiko Tajiri, Tsubasa Tanaka, Yuriko Adachi, Yukari Tanaka, Mika K. Kaneko, Yukinari Kato, Satoko Akashi, Yoshinori Akiyama, Yohei Hizukuri, Takayuki Kato, Terukazu Nogi (2025). Cryo-EM structure of the bacterial intramembrane metalloprotease RseP in the substrate-bound state. Science Advances, 11, 9, eadu0925.