2021-02-10 理化学研究所
理化学研究所(理研)生命機能科学研究センター器官誘導研究チームの辻孝チームリーダー、武尾真上級研究員らの共同研究グループは、毛包再生能力を維持したまま毛包幹細胞を生体外で100倍以上増幅する培養方法を確立し、さらに長期間にわたる周期的な毛包再生に必要な幹細胞集団を明らかにしました。
本研究の成果は、発生生物学など基礎的研究に貢献するとともに、次世代器官再生医療である毛包再生医療を実現すると期待できます。
動物のほとんど全ての器官(臓器)は発生過程において形成され、出生後に再び作り直されることはありませんが、毛髪を作り出す「毛包」という器官は唯一、生涯にわたって周期的な「器官再生」を繰り返します。毛包には、複数種の上皮性幹細胞[1]が存在しますが、長期間の周期的な毛包再生を可能とする細胞集団の実体は長らく不明なままで、その生体外増幅法も確立されていませんでした。
今回、共同研究グループは、毛包器官誘導能を持つ上皮性幹細胞を生体外で増幅する培養系を確立し、毛包上皮性幹細胞の毛包形成能力を制御するとともに、長期間の毛包器官再生に必要な幹細胞集団を明らかにしました。さらに、この幹細胞集団は、マウスとヒトの天然毛包中においては、毛包幹細胞ニッチ[2]であるバルジ領域の上部に細胞外基質[3]の糖タンパクである「テネイシン」とともに局在しており、テネイシンが毛包器官誘導能を持つ上皮性幹細胞の未分化性維持のニッチを形成している可能性が示されました。
本研究は、オンライン科学雑誌『Scientific Reports』(2月10日付)に掲載されます。
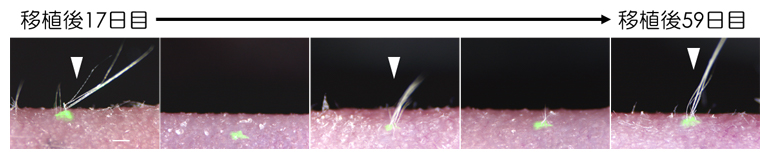
マウス培養毛包上皮性幹細胞による周期的な毛幹(皮膚外に露出している部分、矢尻)の再生
背景
動物の器官は、胎児期において器官誘導能を持つ上皮性幹細胞と間葉性幹細胞[1]の相互作用により形成され、出生後は体性幹細胞によって維持されます。体性幹細胞は器官誘導能を持たないため、病気やケガ、老化によって器官が機能不全に陥っても器官を再生することはできません(図1)。
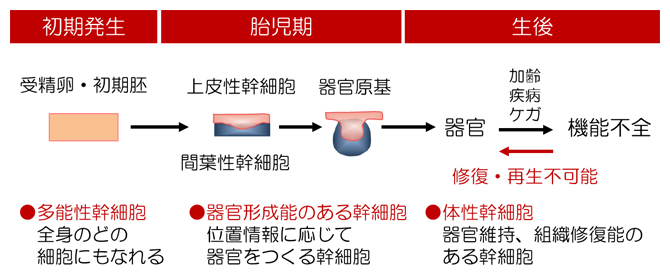
図1 哺乳類における器官発生および維持の概念図
器官は胎児期において、器官誘導能のある胎児性幹細胞によって形成される。体性幹細胞は器官誘導能を持たないため、加齢や疾病などで器官が機能不全に陥ると元に戻れない。
現在の再生医療は、幹細胞移入療法や、皮膚シートや軟骨など同一細胞種からなる組織の移植が行われており、社会実装されています。次世代再生医療は、複数の細胞種からなる器官・臓器(臓器は内臓諸器官を指し、器官に包含される)をまるごと再生させ、機能不全に陥った器官と置き換える器官置換再生医療であり、発生学、医学における重要な研究対象として世界的に研究が進められています。
器官再生医療の研究トレンドとして、①胎児期の器官誘導能を持つ幹細胞から器官のもととなる器官原基を再生して器官へと発生させる方法、並びに②ES細胞[4]やiPS細胞[4]などの多能性幹細胞[4]に位置情報を与えてさまざまなミニ器官を誘導するオルガノイド[5]研究が知られています。辻孝チームリーダーらは2007年に、世界に先駆けて胎児性上皮性幹細胞・間葉性幹細胞を三次元的に操作する「器官原基法」を開発し、外胚葉性器官である歯や毛包、分泌腺の再生器官原基を生体内に同所的に移植して機能することを実証しました注1-2)。一方、2008年から世界で報告されてきたオルガノイド研究では、ほとんど全ての器官の構造と機能の一部を再生させることが可能になっているものの、オルガノイドは器官の機能と構造の一部を再現したミニ器官にとどまっており、生体内で完全に器官機能を発現させるには至っていません。
毛髪を作り出す器官である「毛包」は、哺乳類において生涯にわたり再生を繰り返す唯一の器官です。毛包は、皮脂腺や毛包上皮性幹細胞が存在するバルジ領域を含む不変部と、毛髪を作り出す工場である毛球部を含む可変部に分けられ、可変部はマウスでは約3週間、ヒトでは5~7年周期で退縮と再生を繰り返し(毛周期)、毛髪が生え変わります(図2)。この過程において、毛包上皮性幹細胞と毛乳頭細胞(間葉性幹細胞を含む)が相互作用することで毛包器官が再生されます(図2)。これは、毛包上皮性幹細胞および間葉性幹細胞が出生後も器官誘導能を維持していることを示しており、次世代器官再生医療である毛包再生医療のための細胞ソースとして期待されています。
毛包は、皮脂腺の維持を担う細胞や可変部の再生を担う細胞、両者を生み出す細胞など、機能の異なる複数の幹細胞によって維持、再生されます(図2)。それぞれの幹細胞の維持や増殖、分化に関わる分子メカニズムは明らかにされつつあるものの、周期的な毛包再生を可能とするメカニズムは明らかになっていませんでした。このため、周期的な毛包再生を可能とする幹細胞を増幅する方法は確立しておらず、毛包再生医療実現のための大きな課題でした。
そこで共同研究グループは、毛包器官誘導能の異なる毛包上皮性幹細胞の培養条件を開発し、これらの培養細胞集団を比較することにより、長期間の再生の維持に必要な幹細胞集団を明らかにすることを試みました。
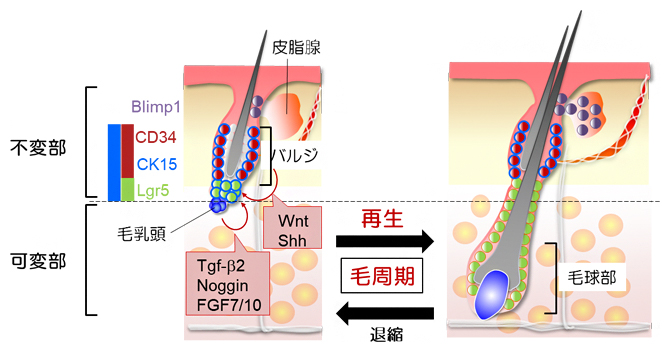
図2 毛包の再生と退縮
毛包は、皮脂腺や毛包上皮性幹細胞が存在するバルジ領域を含む不変部と、毛髪を作り出す工場である毛球部を含む可変部に分けられる。可変部は生涯にわたって退縮と再生を繰り返す。Blimp1陽性細胞(紫)は皮脂腺の維持を、Lgr5陽性細胞(緑)は可変部の再生を担う。バルジ領域のCD34とCK15の二重陽性細胞(赤)はBlimp1陽性細胞とLgr5陽性細胞を生み出す。バルジ領域と毛乳頭細胞(青)が相互作用することで毛包器官が再生される。
注1)2015年12月24日プレスリリース「歯の原基を操作して歯の数を増やす技術開発に成功」
注2)2016年4月2日プレスリリース「マウスiPS細胞から皮膚器官系の再生に成功」
研究手法と成果
1)周期的な毛包再生を可能とする毛包上皮性幹細胞培養系の確立
共同研究グループは、周期的な毛包再生に必要な幹細胞集団を明らかにするため、生体外でさまざまな培養方法を試みました。初めに、毛包上皮性幹細胞の維持や増殖に関連するシグナル経路に関わるサイトカイン[6]や低分子化合物、培養足場材料などの組み合わせについて、220通り以上の培養条件を検討しました(図3a)。この結果、BMPシグナル[7]を抑制するNoggin、線維芽細胞増殖因子(FGF)、HHシグナル[7]を活性化させるSAG、上皮成長因子(EGF)を含む培地(NFFSE培地)で、アテロコラーゲンゲル[8]を用いて立体培養すると、毛包器官誘導能を持つ上皮性幹細胞が最も高い増殖率を示し、6日間の培養で約190倍にまで増幅できることが明らかになりました(図3b)。
また、蛍光活性化セルソーティング(FACS)[9]による増幅細胞集団の解析では、バルジ領域幹細胞のマーカーであるCD34/Itg 6(インテグリン 6)二重陽性細胞が全体の4%から70.8%に増加することが認められました(図3c,d)。一方で、この培地からEGFを除いた培地(NFFS培地)やWntシグナル[7]およびNotchシグナル[7]を活性化させるサイトカインを加えた培地(NFFSWN培地)では、CD34/Itg 6二重陽性細胞の割合がそれぞれ56.2%および30.6%と、NFFSE培地に比べて低い増加率を示しました(図3d)。NFFS培養細胞では、毛包下部の再生を担う幹細胞のマーカーであるLgr5の発現が137.6倍、NFFSWN培養細胞では、皮脂腺幹細胞のマーカーであるBlimp1の発現が9.01倍まで上昇していました。これらのことから、NFFSE培地が器官再生能のある毛包上皮性幹細胞を未分化状態で維持しながら増幅することが示唆されました(図3e)。
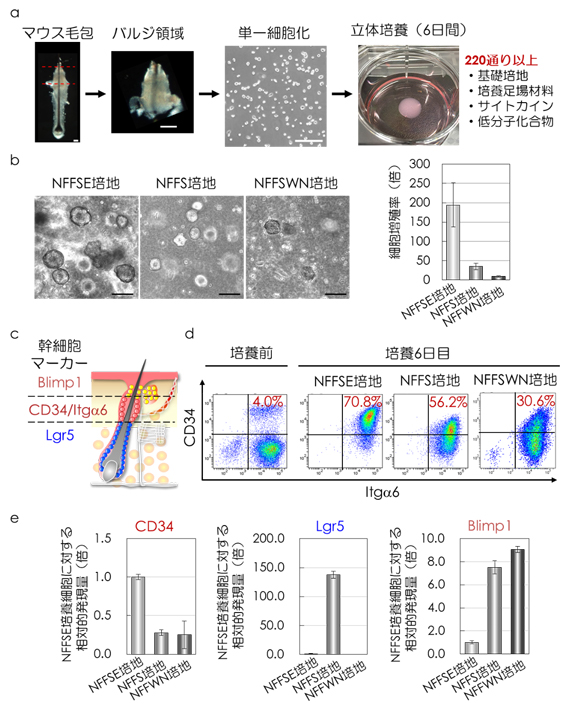
図3 未分化状態を維持する毛包上皮性幹細胞培養法の確立
a)毛包バルジ細胞の立体培養イメージ。
b)培養6日目における位相差顕微鏡像(左)と細胞増殖率(右)。NFFSE培地においてバルジ細胞は最も高い増殖率を示す。
c)毛包上皮性幹細胞分布の模式図。
d)培養前後におけるCD34およびItg 6発現細胞の解析。CD34/Itg 6二重陽性細胞の割合はいずれの培養条件においても増加するが、NFFSE培地で最も高い割合を示した。
e)培養後の遺伝子発現解析。NFFS培養細胞では毛包下部のマーカーであるLgr5の発現が、NFFSWN培養細胞では毛包上部のマーカーであるBlimp1の発現が上昇している。スケールバーは全て100m(μm、1μmは1000分の1mm)。
そこで、培養細胞の器官誘導能を明らかにするため、器官原基法により毛包原基を再生し、ヌードマウス[10]皮内へ同所的に移植を行ったところ、NFFSE培養細胞およびNFFS培養細胞を用いた再生毛包原基から、同程度の毛包再生(再生毛の萌出)が認められました(図4a,b)。周期的な毛包の再生回数には違いが認められ、NFFS培養細胞では79.0%の毛包が2回以下の毛周期しか示さないのに対し、NFFSE培養細胞から再生した毛包の81.0%が3回以上の毛周期を示したことから、長期的な毛包再生を可能とする毛包上皮性幹細胞の誘導には、NFFSE培養が重要であることが示されました(図4b)。
これらの結果から、周期的な毛包再生能を持つ毛包上皮性幹細胞の生体外培養方法が確立されました。この培養方法を応用することで、ヒト頭髪バルジ由来細胞が1毛包から4,000倍に増幅され、同一期間内に毛乳頭細胞が約100倍に増幅されることから、最終的に1毛包から約100毛包相当まで増幅可能となり、毛包再生医療の臨床応用の実現に大きく前進しました。
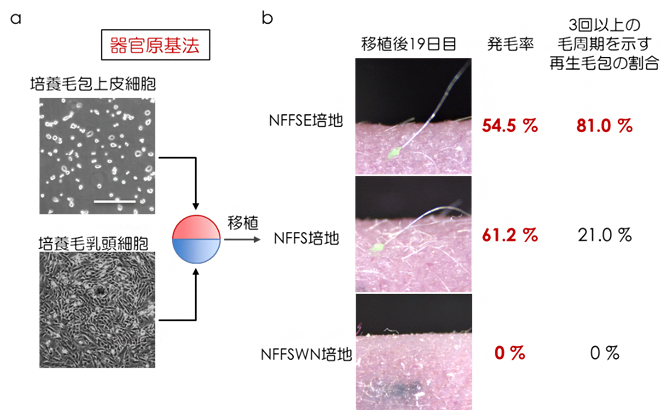
図4 器官原基法による培養細胞の機能解析
a)培養毛包上皮細胞および毛乳頭細胞を用いた器官原基法の模式図。コラーゲンゲル内において2種類の細胞を高密度で立体的に区画化し配置することにより、器官のもととなる器官原基を再現できる。
b)再生毛包原基をヌードマウス皮内へ移植後19日目の実体顕微鏡像と発毛率および3回以上の毛周期を示す再生毛包の割合。NFFSE培養細胞から再生した毛包の多く(81.0%)が3回以上の毛周期を示した。
2)持続的な毛包再生に必要な幹細胞集団の特定
1)の結果から、NFFSE培養細胞中には持続的な毛包再生を可能とする幹細胞集団が含まれていると予想されました。そこで、その細胞集団を明らかにするため、NFFSE培地で培養した細胞と、限定的な毛周期を示すNFFS培地で培養した細胞集団の特徴を細胞表面マーカーの発現により比較しました。一般的に、幹細胞の自己複製には細胞外分子群が重要な役割を果たしているため、細胞接着分子および細胞外基質の発現を比較したところ、NFFSE培養細胞集団には、バルジ幹細胞であるCD34/Itg 6二重陽性細胞集団中にインテグリン 5(Itg 5)を高発現する細胞集団が含まれることが明らかになりました(図5a)。
そこで、NFFSE培養細胞からCD34/ Itg 6/Itg 5三重陽性細胞を除去し、機能解析を行ったところ、3回以上の毛周期を示す再生毛包の割合が79.9%から13.3%へと大幅な減少が認められました(図5b)。また、細胞系譜解析[11]では、再生毛包において三重陽性細胞は皮脂腺、バルジ領域、および毛球部を含む毛包可変部に分化することが示されました。
これらの結果から、再生毛包においてCD34/ Itg 6/Itg 5三重陽性細胞が周期的な毛包再生に必要であることが示されました。
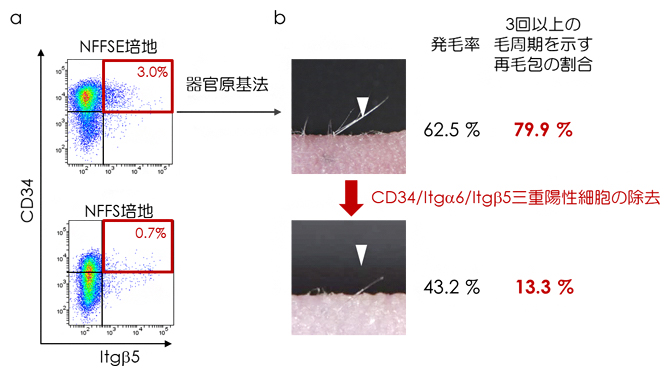
図5 培養後の細胞集団解析とCD34/ Itg 6/Itg 5三重陽性細胞の機能試験
a)培養細胞の細胞表面マーカー解析。NFFSE培養細胞においてはCD34/Itg 6/Itg 5三重陽性細胞の割合が高い。
b)NFFSE培養細胞の発毛機能解析。NFFSE培養細胞集団からCD34/Itg 6/Itg 5三重陽性細胞を除去すると3回以上の毛周期を示す再生毛包の割合が減少することから、三重陽性細胞が周期的な毛包再生に必要であることが分かる。
3)天然毛包におけるItg 5陽性細胞の発現解析
培養実験で観察されたCD34/ Itg 6/Itg 5三重陽性細胞の毛包における局在を明らかにするため、免疫染色による解析を行ったところ、マウスおよびヒト頭髪毛包では、サイトケラチン15(CK15)陽性バルジ領域の上部においてItg 5発現細胞の局在が認められました(図6a上段)。また、この領域においてEGF様ドメインを持ち、細胞接着分子のインテグリンと結合する細胞外基質の糖タンパク質である「テネイシン」の発現が認められました(図6a中下段)。
これらの結果から、天然毛包においてCK15陽性バルジ細胞に機能的な多様性が存在し、Itg 5陽性細胞が長期間の毛周期の維持に必要であり、テネイシンがItg 5陽性細胞のニッチとして機能している可能性が示されました(図6b)。
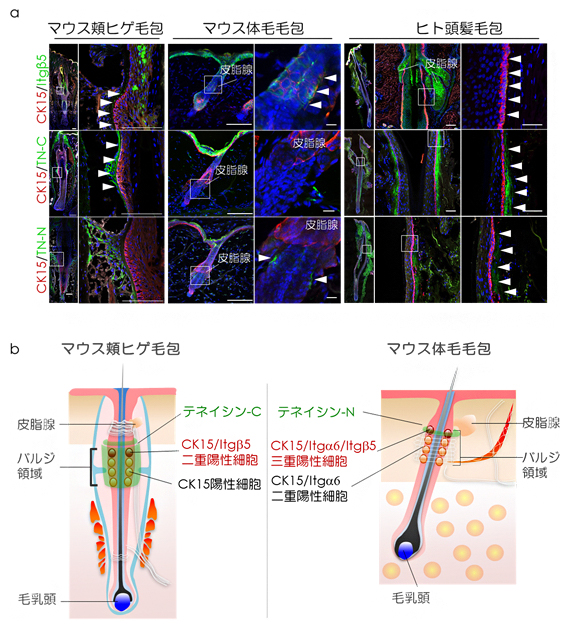
図6 免疫組織染色によるItg 5陽性細胞の天然毛包における局在解析
a)免疫染色による天然毛包における空間的タンパク発現解析。マウス頬ヒゲ毛包、マウ体毛毛包、およびヒト頭髪毛包において、Itg 5陽性細胞(緑)はCK15陽性バルジ領域上部に存在し(上段)、テネイシン(TN-CおよびTN-N)とともに局在していることが分かる(中下段)。矢尻はItg 5、TN-CまたはTN-N発現領域を示す。スケールバーは全て50m。
b)マウス天然毛包におけるItg 5陽性細胞およびテネイシン分布の模式図。CK15陽性バルジ細胞に機能的な多様性が存在し、Itg 5陽性細胞が長期間の毛周期の維持に必要であり、テネイシンがItg 5陽性細胞のニッチとして機能している可能性がある。
今後の期待
本研究により、周期的な毛包再生能を維持したまま毛包上皮性幹細胞を増幅できる培養方法の開発に成功するとともに、長期間の器官誘導能力の維持にはCD34/ Itg 6/Itg 5三重陽性細胞が重要であることが明らかとなりました。
本成果は、毛包上皮性幹細胞の周期的な毛包再生や分化、運命決定のメカニズムや、上皮性幹細胞間の細胞系譜の理解などの幹細胞生物学研究に大きな貢献するとともに、「なぜほとんど全ての体性幹細胞は器官誘導能を失っているのか」、「どうやったら組織幹細胞においても器官誘導能を維持できるのか」という、発生生物学上の根本的な問いに答える足掛かりになるものと期待できます。
また、本研究により確立された培養方法を応用することで、少数の毛包から大量の再生毛包を人為的に製造できることから、世界初の器官再生医療である毛包器官再生医療(毛髪再生)の実現に大きく貢献すると期待できます。
補足説明
1.上皮性幹細胞、間葉性幹細胞
脊椎動物の体を構成する細胞は、外胚葉、中胚葉、内胚葉と呼ばれる3種類の細胞群から生じる。上皮は外胚葉や内胚葉に由来し、皮膚や消化器官の表面を覆う表皮や上皮が含まれる。間葉は中胚葉に由来し、皮膚の真皮や筋肉などが含まれる。上皮性および間葉性幹細胞は、上皮および間葉性のさまざまな細胞に分化できる。
2.幹細胞ニッチ
生体内で幹細胞がその性質を維持するために必要な微小環境。サイトカインや細胞外基質を介して周囲の細胞と相互作用することにより、未分化状態が維持される。
3.細胞外基質
細胞周囲の空間を充填する物質であり、物理的な支持体として細胞の足場の役割を果たすほか、細胞内へのシグナル伝達にも関与する。
4.ES細胞、iPS細胞、多能性幹細胞
さまざまな細胞に分化できる幹細胞は多能性幹細胞と呼ばれる。ES細胞(胚性幹細胞)は、哺乳類の着床前胚(胚盤胞)に存在する多能性幹細胞(内部細胞塊)から樹立した細胞。iPS細胞(人工多能性幹細胞)は、体細胞に特定の遺伝子を導入することで分化多能性を獲得した細胞。
5.オルガノイド
生体内での器官形成過程を生体外で再現することで、多能性幹細胞または体性幹細胞から自己組織化によって形成されるミニ器官であり、生体内の器官の構造と機能の一部を再現する。
6.サイトカイン
細胞から分泌される生理活性を持つタンパク質の総称。細胞間相互作用に関与し、周囲の細胞の増殖や分化などに影響を与える。
7.BMPシグナル、HHシグナル、Wntシグナル、Notchシグナル
それぞれ分泌性タンパク質(骨形成タンパク質(BMP)、ヘッジホッグ(HH)タンパク質、Wntタンパク質)または細胞表面受容体(Notch)を介したシグナル経路。幹細胞の増殖や分化を制御に関わるほか、初期発生やがんなど多様な生命現象に関与する。
8.アテロコラーゲンゲル
真皮や骨などを構成する細胞外基質の一つであるコラーゲンの一部を除去したもの。生体にとって異物と認識される程度が低い(低抗原性)ため、医療機器としても使用される。
9.蛍光活性化セルソーティング(FACS)
光散乱および蛍光特性に基づいて、不均一な細胞集団から特定の細胞を分離する方法。FACSはfluorescence-activated cell sortingの略。
10.ヌードマウス
胸腺の劣化あるいは欠損を引き起こす突然変異マウス。T細胞数の著しい減少が生じ、低い免疫応答を示すため、細胞などの移植実験によく用いられる。毛幹形成に異常が生じ、毛が無いように見えるためヌードマウスと呼ばれる。
11.細胞系譜解析
1個または少数の細胞にマーカーを導入し、標識された細胞およびその細胞から分裂した子孫細胞がどのような細胞に分化したか、組織内のどこに分布するかなどを調べる手法。
共同研究グループ
理化学研究所 生命機能科学研究センター 器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)
上級研究員 武尾 真(たけお まこと)
研究員(研究当時) 浅川 杏祐(あさかわ きょうすけ)
研究員 小川 美帆(おがわ みほ)
北里大学 医学部 形成外科・美容外科
客員教授 佐藤 明男(さとう あきお)
(東京メモリアルクリニック 理事長)
岩手医科大学
教授 入江 太朗(いりえ たろう)
東京メモリアルクリニック
院長 栁澤 正之(やなぎさわ まさゆき)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(A)「次世代器官再生医療のための基盤技術の開発(研究代表者:辻孝)」、基盤研究(A)「皮膚附属器を有する革新的三次元皮膚評価モデル、バイオスキンの開発(研究代表者:辻孝)」、研究活動スタート支援「器官誘導能をもつ毛包幹細胞の同定と分子機構の解明(研究代表者:武尾真)」、内藤記念科学奨励金・研究助成「器官誘導能をもつ毛包幹細胞の同定とその誘導メカニズムの解明(研究代表者:武尾真)」、および株式会社オーガンテクノロジーズ、京セラ株式会社による研究費の支援により行われました。
原論文情報
Makoto Takeo, Kyosuke Asakawa, Koh-ei Toyoshima, Miho Ogawa, JingJing Tong, Tarou Irié, Masayuki Yanagisawa, Akio Sato and Takashi Tsuji, “Expansion and characterization of epithelial stem cells with potential for cyclical hair regeneration”, Scientific Reports, 10.1038/s41598-020-80624-3
発表者
理化学研究所
生命機能科学研究センター 器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)
上級研究員 武尾 真(たけお まこと)
報道担当
理化学研究所 広報室 報道担当