2021-08-11 慶應義塾大学医学部,日本医療研究開発機構
慶應義塾大学医学部医化学教室の加部泰明准教授、小池一康(大学院医学研究科博士課程2年生)、および末松誠教授らの研究グループは、多くの漢方薬に含まれる甘草の主成分グリチルリチン(GL)およびその誘導体がヘム結合性膜タンパク質PGRMC1に結合し、抗がん剤の効果を強力に高めることを発見しました。
同グループはこれまでにPGRMC1がさまざまな固形がんに高発現しており、がん細胞の増殖や薬剤耐性獲得に極めて重要な役割を果たしていることを報告してきました。PGRMC1は、がん治療の標的蛋白質として注目されていますが、PGRMC1の機能を阻害するような物質は未発見でした。本研究では、GLがPGRMC1に結合する分子構造を解明し、上皮成長因子EGFシグナル抑制およびLDLコレステロールの取り込みを抑制することにより、抗がん剤の効果を高め、マウスがん移植モデルにおいてもがん細胞増殖を抑えることを明らかにしました。さらに、GLの誘導体であるグルコグリチルリチンは、より強力にPGRMC1の機能を阻害してがん細胞の増殖を抑えることを発見しました。
これらの成果よりGL誘導体が、がん細胞に多く存在するPGRMC1の機能を制御して抗がん剤の効果を顕著に高めることを示しており、新規のがん治療薬として応用されることが期待されます。
本研究成果は、2021年6月30日(英国時間)に科学誌『Cancers』のオンライン速報版で公開されました。
研究の背景
PGRMC1(progesterone receptor membrane associated component 1)は、多種のがん細胞に高発現しており、がん細胞の生存や増殖に重要な働きをしていると考えられています。2016年に本研究グループは、PGRMC1タンパク質の構造解析(注1)に成功し、ヘム(注2)と結合して特異な2量体構造(ヘムスタッキング構造)を形成していることを明らかにしました。さらに、がん増殖に関わるEGF受容体(注3)や、抗がん剤の分解に関わる酵素であるシトクロームP450(注4)に結合し、がん細胞の増殖や抗がん剤耐性に関わることを解明しました(参考文献)。PGRMC1はがん細胞の悪性化に重要な役割を果たすことから、新しいがん治療標的として考えられていましたが、PGRMC1の機能を抑制する薬剤は見つかっていませんでした。
本研究では、アフィニティナノビーズ(注5)の技術を用いて、多くの漢方薬に含まれる甘草の主成分であるグリチルリチン(GL)が、PGRMC1に結合することを発見し、PGRMC1の機能を抑えることで、PGRMC1を介したがん細胞の増殖や抗がん剤耐性に対して効果を示すことを解明しました。
研究の内容
本研究グループは、アフィニティナノビーズ技術を用いて、GLがPGRMC1に特異的に結合する事を発見しました(図1A、不活性薬剤GAと比較して活性型のGL選択的にPGRMC1が結合)。核磁気共鳴法(NMR、注6)による薬剤結合構造の解析から、GLがPGRMC1のヘム2量体化によって生じたポケット構造に選択的に結合することが分かりました(図1B)。さらに、甘草から抽出されたGL誘導体のグルコグリチルリチン(GlucoGL)はGLよりも非常に高い親和性を示してPGRMC1と結合することを見出しました。GL誘導体はPGRMC1と結合することにより、PGRMC1とがん増殖に必要なEGF受容体(EGFR)との会合を阻害して、EGFRのシグナルの活性化(p:リン酸化)を抑えることが分かりました(図1C)。また、GL誘導体はPGRMC1とLDLコレステロールの取り込みに関わるLDL受容体(LDLR)との会合も阻害し、LDLの細胞取り込みも抑制しました(図1D)。これらの結果から、GL誘導体はPGRMC1の機能を阻害してがん細胞の増殖シグナルや栄養素の取り込みを抑制することにより、GLに比べ高い効果を発揮することが示唆されました。
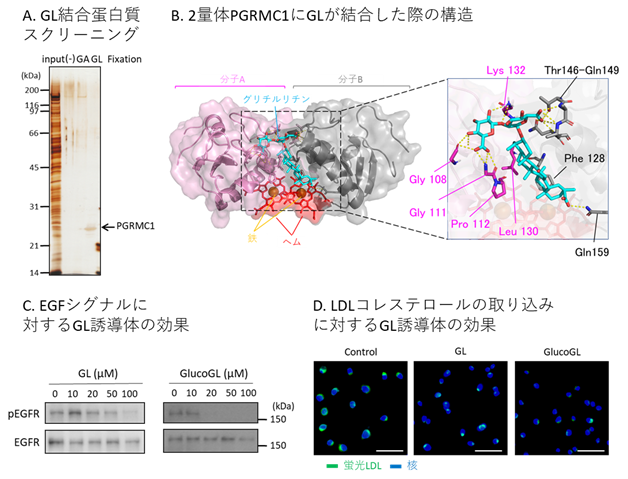
図1 GLとPGRMC1の結合および、GL誘導体によるPGRMC1の機能阻害
A. GL結合タンパク質のスクリーニング。GLにPGRMC1が特異的に結合する。
B. 2量体化PGRMC1のGL結合構造。
C. EGFシグナルに対するGL誘導体の効果。GLおよびGlucoGLを投与することでリン酸化EGFR(pEGFR)が減少する。
D. LDLコレステロール取り込みに対するGL誘導体の効果。GLおよびGlucoGLを投与することにより蛍光標識LDLのがん細胞への取り込みが抑制される。
さらに、GL誘導体による抗がん効果を検証した結果、ヒト大腸がん細胞(HCT116細胞)において抗がん剤のシスプラチン(CDDP)とGL誘導体を併用すると、CDDPのみ投与時と比較して顕著に細胞生存率が低下して抗がん剤に対する感受性が増加していることが分かりました(図2A)。また、免疫不全ヌードマウスを用いたHCT116細胞の異種皮下移植モデルにおいて、CDDPとGL誘導体を投与すると、CDDP単剤やGL誘導体単剤ではコントロール群と腫瘍の成長に大きな変化ありませんが、CDDPとGL誘導体を併用すると明らかに腫瘍増殖が抑制されることが観察されました(図2B)。
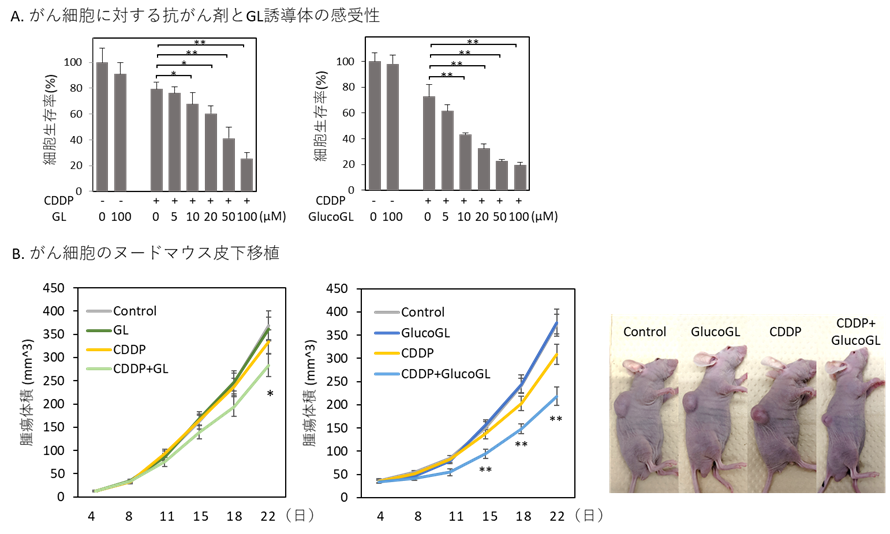 図2 がん細胞に対する抗がん剤とGL誘導体の効果
図2 がん細胞に対する抗がん剤とGL誘導体の効果
A. がん培養細胞に対する抗がん剤とGL誘導体の感受性。CDDPのみでは効果は限定的だが、GL(左)またはGlucoGL(右)を併用すると抗がん効果が増大し細胞生存率は低下する。
B. がん細胞のヌードマウス皮下移植。CDDPやGL誘導体のみでは腫瘍体積に変化ないが、GL(左)、GlucoGL(右)を併用すると腫瘍体積の増加を抑える。写真はマウスのわき腹に移植されたがん細胞を示し、CDDPとGlucoGL投与した群では腫瘍体積が小さい。
以上の結果から、GL誘導体はPGRMC1に結合することにより、PGRMC1と結合するEGF受容体およびLDL受容体の機能を阻害し、がん細胞の増殖やLDLコレステロールの取り込み量を抑制することで抗がん作用を発揮していることが明らかになりました(図3)。
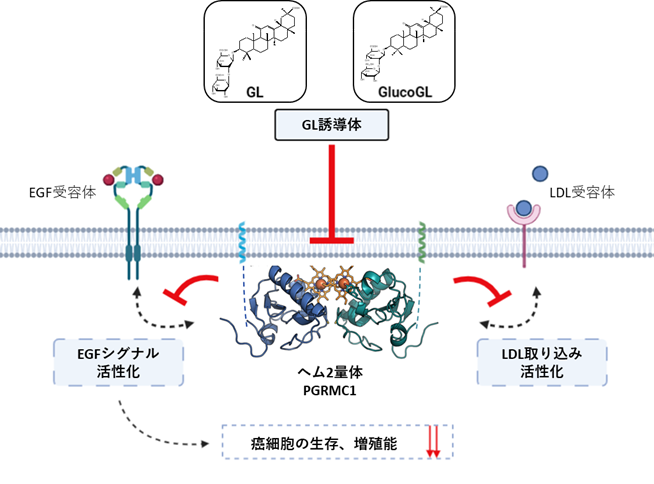
図3 がん細胞におけるPGRMC1を介したGL誘導体の抗がん作用のモデル図GL誘導体はヘム2量体PGRMC1に結合し、EGFシグナルとLDL取り込み抑制効果を発揮することにより抗がん作用を示す。
研究の意義・今後の展開
日本における死因として最も多いのは悪性新生物であり、がん治療技術のさらなる発展は必要不可欠です。本研究成果は、PGRMC1が多種のがん細胞において重要な役割を果たしていますが、GL誘導体がPGRMC1を介して強い抗腫瘍効果を有していることを明らかにしました。抗がん剤とGL誘導体の併用療法は、新たながん治療戦略の構築に発展することが期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構 革新的先端研究開発支援事業ユニットタイプ「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域「代謝システム制御分子の系統的探索による治療戦略創出と創薬展開」、国立研究開発法人科学技術振興機構 ムーンショット型研究開発事業「2050年までに、超早期に疾患の予測・予防をすることができる社会を実現」研究領域「生体内ネットワークの理解による難治性がん克服に向けた挑戦」、国立研究開発法人科学技術振興機構戦略的創造研究推進事業(JST-ERATO、末松ガスバイオロジープロジェクト)およびJSPS科研費JP18K06921の支援により行われました。なお、末松教授は、本研究に関する研究開発費をAMEDから受給していません。
論文
- 英文タイトル
- Glycyrrhizin derivatives suppress cancer chemoresistance by inhibiting Progesterone Receptor Membrane Component 1
- タイトル和訳
- グリチルリチン誘導体はPGRMC1を阻害してがんの薬剤感受性を制御する
- 著者名
- 加部泰明、小池一康、山本達也、平井美和、金井彩香、古旗了伍、津川仁、原田英里砂、菅瀬謙治、吉川展司、林宏明、野田勝紀、内山進、山崎広貴、田中廣壽、小林拓也、半田宏、末松誠
- 掲載誌
- Cancers(オンライン速報版)
- DOI
- 10.3390/cancers13133265
用語解説
- (注1)構造解析
- 目的タンパク質の結晶を用いたX線解析によりタンパク質の高次構造を解析した。
- (注2)ヘム
- 2価の鉄原子とポルフィリンから成る錯体であり、ヘモグロビンなどの酸素運搬や酸化還元酵素の補因子として働く。
- (注3)EGF受容体
- 細胞の増殖を促進する上皮成長因子(EGF)の受容体であり、いくつかのがん細胞ではこの機能が亢進して悪性度が増強することが知られる。
- (注4)シトクロームP450酵素
- 薬物代謝、解毒に関与する酸化酵素ファミリーで抗がん剤の不活性化にも関わることが知られる。
- (注5)アフィニティナノビーズ
- 目的の分子をナノビーズに固定化し、結合する標的タンパク質の同定および解析を行う技術。
- (注6)核磁気共鳴法NMR
- 強力な磁場を用いて、物質を構成している原子の特定および原子の結合様式を解析する技術。
参考文献
- タイトル
- Haem-dependent dimerization of PGRMC1/Sigma-2 receptor facilitates cancer proliferation and chemoresistance
- 掲載誌
- Nature Communications(2016年)
- DOI
- 10.1038/ncomms11030
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部 医化学教室
准教授 加部 泰明(かべ やすあき)
AMED事業に関すること
日本医療研究開発機構
シーズ開発・基盤研究基盤事業部 革新的先端研究開発研究企画課