IGF三元複合体の低温電子顕微鏡構造とその組立・活性化機構を解明 Scientists determined the cryo-EM structure of IGF Ternary complex and its assembly & activation mechanism
2022-08-10 大韓民国・基礎科学研究院(IBS)
研究チームは、IGF1/IGFBP3/ALS三元複合体の構造を初めて決定した。この構造情報は、成長ホルモン欠乏症やALS欠乏症などの成長関連疾患の理解を広げることができると考えられてる。
この安定な三元複合体は、動物細胞発現系と一連の精製工程を経て、発現・精製に成功しました。IBSの低温透過電子顕微鏡(クライオ電子顕微鏡)、データハブ、スーパーコンピューティングリソースを用いて、その高分解能3次元分子構造を取得した。その結果、IGF1がIGFBP3に取り囲まれ、まず二重の複合体を形成していることが判明しました。そして、この二重複合体をALSがもう一度パラシュートのように包み込み、IGF1が体内で容易に分解されないように保護していることがわかりました。
ALSの既知の点変異の多くは、ALSのミスフォールディングを誘発し、三元複合体の形成を阻害することで疾患を引き起こすことがわかった。一方、IGFの既知の点変異は、複合体を形成する能力に悪影響を及ぼすことはなく、むしろIGFのIGF受容体への親和性を低下させることで疾患を引き起こすことがわかった。
IGFBP3やIGF1だけではALSとの二重複合体を形成できないことがわかった。さらに、IGFはまずIGFBPと二重複合体を形成する必要があり、その後に両タンパク質がALSに結合して初めて三重複合体を適切に形成できることが明らかになった。
研究チームはIGFBPを改変し、タンパク質の特定のドメインの役割をより明確にしました。N末端ドメイン(NBP)を取り除くと、このタンパク質はIGFと結合できなくなることが示され、このドメインが最初の二重複合体形成に必要であることが示唆された。
IGFBPのC末端ドメイン(CBP)が遊離し、不安定な中間体の三元複合体が形成されることが確認された。この過程は、複合体内で結合していると不活性なIGFを活性化する重要なステップであると考えられた。
<関連情報>
- https://www.ibs.re.kr/cop/bbs/BBSMSTR_000000000738/selectBoardArticle.do?nttId=21866&pageIndex=1&searchCnd=&searchWrd=
- https://www.nature.com/articles/s41467-022-32214-2
IGF/IGFBP/ALS三元複合体の組立・分解の構造的基盤(Structural basis for assembly and disassembly of the IGF/IGFBP/ALS ternary complex)
Hyojin Kim,Yaoyao Fu,Ho Jeong Hong,Seong-Gyu Lee,Dong Sun Lee & Ho Min Kim
Nature Communications Published:30 July 2022
DOI:https://doi.org/10.1038/s41467-022-32214-2
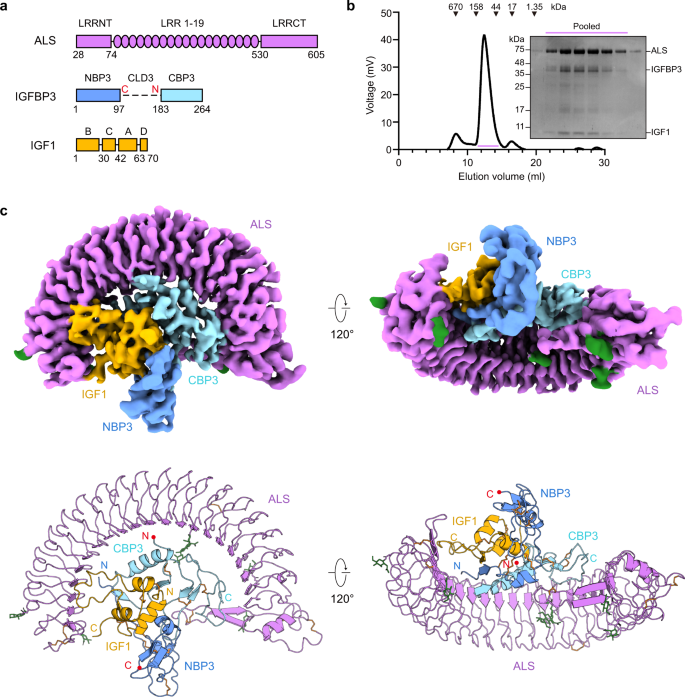
Abstract
Insulin-like growth factors (IGFs) have pleiotropic roles in embryonic and postnatal growth and differentiation. Most serum IGFs are bound in a ternary complex with IGF-binding protein 3 (IGFBP3) and acid-labile subunit (ALS), extending the serum half-life of IGFs and regulating their availability. Here, we report cryo-EM structure of the human IGF1/IGFBP3/ALS ternary complex, revealing the detailed architecture of a parachute-like ternary complex and crucial determinants for their sequential and specific assembly. In vitro biochemical studies show that proteolysis at the central linker domain of IGFBP3 induces release of its C-terminal domain rather than IGF1 release from the ternary complex, yielding an intermediate complex that enhances IGF1 bioavailability. Our results provide mechanistic insight into IGF/IGFBP3/ALS ternary complex assembly and its disassembly upon proteolysis for IGF bioavailability, suggesting a structural basis for human diseases associated with IGF1 and IGFALS gene mutations such as complete ALS deficiency (ACLSD) and IGF1 deficiency.