2022-08-29 スイス連邦工科大学ローザンヌ校(EPFL)
アルツハイマー病やパーキンソン病などの神経変性疾患は、脳内で神経細胞の絡まりを形成し、神経細胞を死滅させる非定型タンパク質と関連している。こうした神経絡まりの形成の基盤となるいくつかの重要なメカニズムを明らかにしました。
また、神経細胞が互いに切り離される神経変性の初期段階における細胞の脆弱性についても調べることができた。
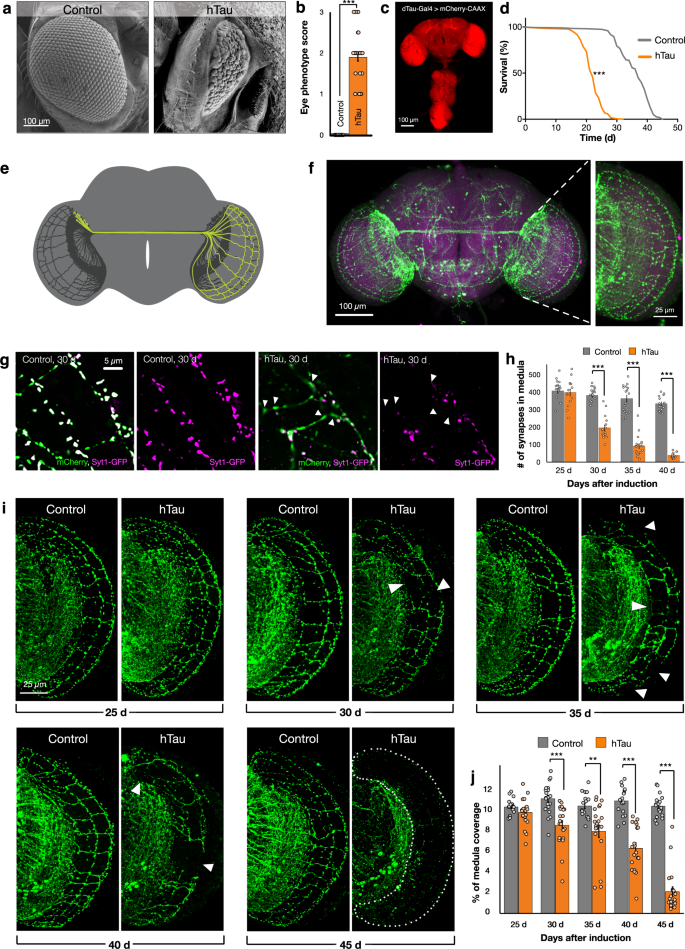
ショウジョウバエの成虫を操作して、アルツハイマー病やその他の認知症に関与するタンパク質であるヒトのタウを発現させた。
ヒトTauを発現させたハエは、対照群に比べ寿命が短いことが判明した。
ヒトのタウを発現させたハエは、対照群と比較して、シナプス(神経細胞間の結合)の大幅な減少を示した。
さらなる実験により、パーキンソン病患者では変異している可能性のあるレトロマーと呼ばれるタンパク質の複合体が失われると、神経変性が加速されることが明らかになった。
<関連情報>
- https://actu.epfl.ch/news/protein-traffic-jam-in-neurons-linked-to-neurodege/
- https://www.nature.com/articles/s41467-022-32683-5
タウオパチーモデルにおけるレトロマー欠損は、タウの切断と毒性を増強する Retromer deficiency in Tauopathy models enhances the truncation and toxicity of Tau
Jamshid Asadzadeh,Evelyne Ruchti,Wei Jiao,Greta Limoni,Catherine MacLachlan,Scott A. Small,Graham Knott,Ismael Santa-Maria & Brian D. McCabe
Nature Communications Published:27 August 2022
DOI:https://doi.org/10.1038/s41467-022-32683-5
Abstract
Alteration of the levels, localization or post-translational processing of the microtubule associated protein Tau is associated with many neurodegenerative disorders. Here we develop adult-onset models for human Tau (hTau) toxicity in Drosophila that enable age-dependent quantitative measurement of central nervous system synapse loss and axonal degeneration, in addition to effects upon lifespan, to facilitate evaluation of factors that may contribute to Tau-dependent neurodegeneration. Using these models, we interrogate the interaction of hTau with the retromer complex, an evolutionarily conserved cargo-sorting protein assembly, whose reduced activity has been associated with both Parkinson’s and late onset Alzheimer’s disease. We reveal that reduction of retromer activity induces a potent enhancement of hTau toxicity upon synapse loss, axon retraction and lifespan through a specific increase in the production of a C-terminal truncated isoform of hTau. Our data establish a molecular and subcellular mechanism necessary and sufficient for the depletion of retromer activity to exacerbate Tau-dependent neurodegeneration.