SARS-CoV-2ウイルスに対する宿主細胞の反応を制御する分子を扱うことで、薬剤耐性や懸念される新型ウイルスに対して脆弱でない新しい治療標的を発見したと期待されている。 By addressing molecules governing how host cells respond to the SARS-CoV-2 virus, researchers hope they’ve found a new therapeutic target less vulnerable to potential drug resistance and emerging variants of concern
2023-01-23 カリフォルニア大学サンディエゴ校(UCSD)
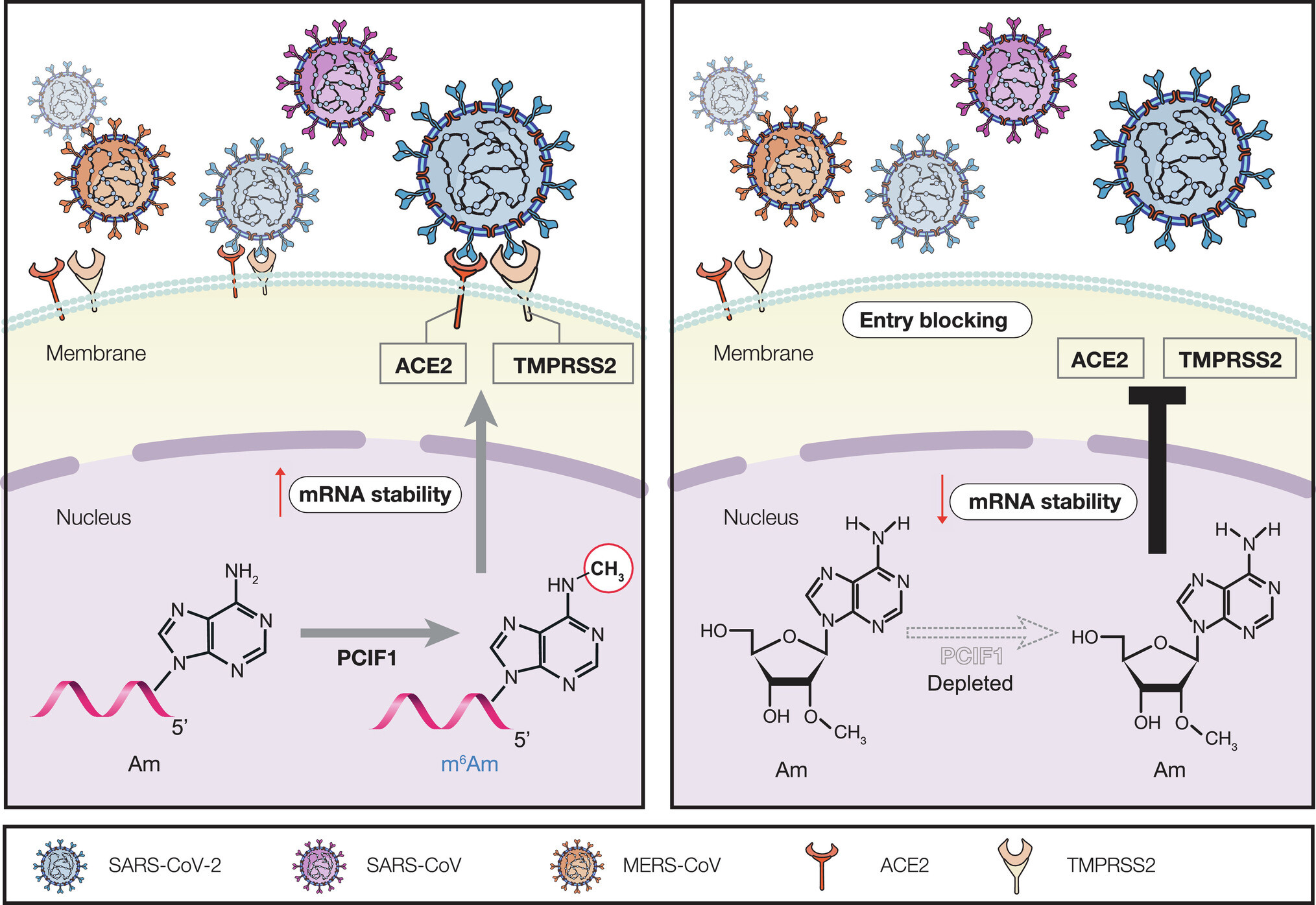
◆SARS-CoV-2ウイルスは、宿主細胞に侵入して感染するために、その特徴的なスパイクタンパク質を展開して、アンジオテンシン変換酵素(ACE2)と呼ばれる細胞表面の受容体に結合し、膜貫通セリンプロテアーゼ2(TMPRSS2)という別の酵素の発現を引き起こし、結果として新しいウイルス粒子が生成されてCOVID-19という病気を進行させるのである。
◆SARS-CoV-2ウイルスの複製と拡散をより困難にするために、ACE2/TMPRSS2経路を阻害または破壊する方法を見つけるために、多くの研究が行われてきた。この酵素は、現在のCOVID-19の変異体だけでなく、今後出現する変異体に対しても、より広範かつ持続的な防御を可能にする新しい治療ターゲットとなる可能性がある。
◆この酵素は、リン酸化CTD相互作用因子1(PCIF1)と呼ばれ、進化的に保存された豊富なmRNA修飾であるN6,2-O-ジメチルアデノシン(m6Am)活性を介した細胞侵入を制御している。研究者らは、PCIF1がACE2とTMPRSS2両方のmRNAの安定性を促進し、SARS-CoV-2や他のコロナウイルスの2つの重要な侵入因子を維持することを見いだした。
<関連情報>
- https://today.ucsd.edu/story/host-cell-factors-involved-in-covid-19-infections-may-augur-improved-treatments
- https://www.pnas.org/doi/10.1073/pnas.2210361120
PCIF1を介したACE2およびTMPRSS2 mRNAの5′-cap N6′-O-dimethyladenosineの沈着がSARS-CoV-2感染感受性を制御していること PCIF1-mediated deposition of 5′-cap N6,2′-O-dimethyladenosine in ACE2 and TMPRSS2 mRNA regulates susceptibility to SARS-CoV-2 infection
Lingling Wang,Shaobo Wang,Lujing Wu,Wanyu Li,William Bray,Alex E. Clark ,Gwendolyn Michelle Gonzalez,Yinsheng Wang,Aaron F. Carlin,Tariq M. Rana
Proceedings of the National Academy of Sciences Published:January 23, 2023
DOI:https://doi.org/10.1073/pnas.2210361120

Significance
Understanding the molecular mechanisms of SARS-CoV-2 viral pathogenesis and developing novel inhibitors are essential and urgent. Using genome-wide N6,2′-O-dimethyladenosine (m6Am)-exo-seq, RNA-seq analysis, and CRISPR/Cas9 genome editing, we discovered that phosphorylated CTD-interacting factor 1 (PCIF1), a cap-specific adenine N6-methyltransferase, plays a major role in facilitating infection of primary human lung epithelial cells and cell lines by SARS-CoV-2, variants of concern, and other coronaviruses. PCIF1 promotes infection by sustaining expression of the coronavirus receptors ACE2 and TMPRSS2 via m6Am-dependent mRNA stabilization. These results suggest a role for PCIF1 and cap m6Am in regulating SARS-CoV-2 susceptibility and identify a potential therapeutic target for prevention of infection.
Abstract
Infection with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) continues to be a major health problem worldwide. Due to the fast emergence of SARS-CoV-2 variants, understanding the molecular mechanisms of viral pathogenesis and developing novel inhibitors are essential and urgent. Here, we investigated the potential roles of N6,2′-O-dimethyladenosine (m6Am), one of the most abundant modifications of eukaryotic messenger ribonucleic acid (mRNAs), in SARS-CoV-2 infection of human cells. Using genome-wide m6Am-exo-seq, RNA sequencing analysis, and Clustered regularly interspaced short palindromic repeats (CRISPR)/Cas9 genome editing, we demonstrate that phosphorylated C-terminal domain (CTD)-interacting factor 1 (PCIF1), a cap-specific adenine N6-methyltransferase, plays a major role in facilitating infection of primary human lung epithelial cells and cell lines by SARS-CoV-2, variants of concern, and other coronaviruses. We show that PCIF1 promotes infection by sustaining expression of the coronavirus receptors angiotensin-converting enzyme 2 (ACE2) and transmembrane serine protease 2 (TMPRSS2) via m6Am-dependent mRNA stabilization. In PCIF1-depleted cells, both ACE2/TMPRSS2 expression and viral infection are rescued by re-expression of wild-type, but not catalytically inactive, PCIF1. These findings suggest a role for PCIF1 and cap m6Am in regulating SARS-CoV-2 susceptibility and identify a potential therapeutic target for prevention of infection.