人工抗原提示足場を用いて、患者さん固有のCAR-T細胞の欠損に合わせた刺激量の微調整を行うことで、より強力なCAR-T細胞製剤の製造が可能となります。 Fine-tuning stimulation doses to deficiencies in patient-specific CAR-T cells, using artificial antigen-presenting scaffolds, enables manufacturing of more potent CAR-T cell products.
2023-02-10 ハーバード大学
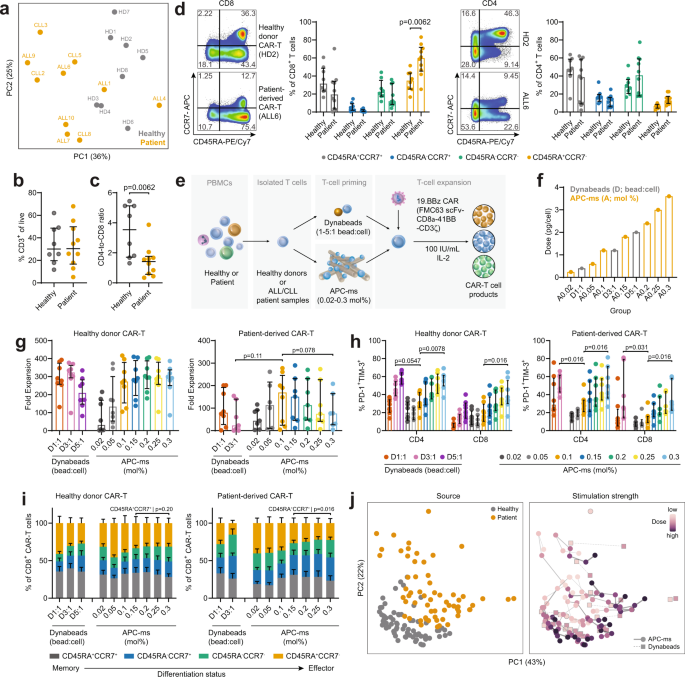
◆CAR-T細胞は、合成の膜貫通型受容体分子を搭載し、外側に面した部分でがん細胞上の抗原に結合し、内側に面した部分がそれに反応して、腫瘍細胞を破壊する強力なプログラムを起動させるように設計されている。しかし、すべての患者がCAR-T細胞療法に同じように反応するわけではなく、がん免疫学者がCAR-T細胞療法の有効性や失敗の原因を解明しようとしてきた。がん患者さんのT細胞と健康な人のT細胞の違いについては理解が進んでいますが、CAR-T細胞の製造工程では、これらの知見は考慮されていません。CAR-T細胞は、T細胞の表現型の違いに関わらず、T細胞特異的なアゴニストと一般的な免疫賦活サイトカインで刺激することで、点滴が可能な細胞として製造されています。
◆このたび、ハーバード大学John A. Paulson School of Engineering and Applied Sciences(SEAS)およびWyss Institute for Biologically Inspired Engineeringの生体工学者(SEASのRobert P. Pinkas Family教授 David Mooney)およびダナファーバーがん研究所(DFCI)のがん免疫学者 Catherine Wuは、CAR-T細胞の製造時に刺激を個人化すると、得られるCAR-T細胞の一貫性と効力が大幅に強化できることを証明しました。研究チームは、人工抗原提示細胞模倣足場(APC-ms)を用いて、白血病患者から得られたT細胞の表現型に合わせてT細胞刺激のレベルを微調整し、ex vivoおよびin vivoでの腫瘍除去能力を大幅に向上させることに成功したのです。この研究成果は、Nature Communicationsに掲載されました。
<関連情報>
- https://seas.harvard.edu/news/2023/02/car-t-cell-cancer-immunotherapy-gets-personal
- https://www.nature.com/articles/s41467-023-36126-7
患者さんに合わせたCAR-T細胞の機能強化 Enhancing CAR-T cell functionality in a patient-specific manner
David K. Y. Zhang,Kwasi Adu-Berchie,Siddharth Iyer,Yutong Liu,Nicoletta Cieri,Joshua M. Brockman,Donna Neuberg,Catherine J. Wu & David J. Mooney
Nature Communications Published:31 January 2023
DOI:https://doi.org/10.1038/s41467-023-36126-7
Abstract
Patient responses to autologous CD19 chimeric antigen receptor (CAR) T-cell therapies are limited by insufficient and inconsistent cellular functionality. Here, we show that controlling the precise level of stimulation during T-cell activation to accommodate individual differences in the donor cells will dictate the functional attributes of CAR-T cell products. The functionality of CAR-T cell products, consisting of a diverse set of blood samples derived from healthy donors, acute lymphoblastic leukemia (ALL), and chronic lymphocytic lymphoma (CLL) patient samples, representing a range of patient health status, is tested upon culturing on artificial antigen-presenting cell scaffolds to deliver T-cell stimulatory ligands (anti-CD3/anti-CD28) at highly defined densities. A clear relationship is observed between the dose of stimulation, the phenotype of the T-cell blood sample prior to T-cell activation, and the functionality of the resulting CAR-T cell products. We present a model, based on this dataset, that predicts the precise stimulation needed to manufacture a desired CAR-T cell product, given the input T-cell attributes in the initial blood sample. These findings demonstrate a simple approach to enhance CAR-T functionality by personalizing the level of stimulation during T-cell activation to enable flexible manufacturing of more consistent and potent CAR-T cells.