2023-02-17 スイス連邦工科大学チューリッヒ校(ETHZurich)
◆中枢神経系の多くの病気は、血液脳関門の損傷と関連しているので、この壁は、医学的観点からも重要です。この関門の働きを解明するために、科学者はしばしば生きた動物を使った実験を行う。しかし、このような実験にはコストがかかる上、動物細胞では人体で起こっていることの一部しか解明できない可能性がある。さらに、動物実験の基本的な有効性を疑問視する批判的な意見もある。そこで、実験室で培養したヒトの細胞を用いた実験が行われている。
◆多くの動物実験モデルの問題点は、血管壁細胞(内皮細胞)を使って比較的単純化された方法で血液脳関門を再現していることである。このアプローチでは、ヒトのシステムの複雑な構造を表現することができず、例えば、さまざまな種類の細胞間のコミュニケーションが無視されている。さらに、これらのモデルの多くは静的である。つまり、細胞は動かない懸濁液の中に浮いており、流体の流れや細胞が体内で受けるシアストレスが考慮されていないことを意味する。
◆また、体内の流動状態をシミュレートする動的な体外モデルもありますが、ポンプが必要なため実験装置が複雑になってしまいます。血液脳関門の構造変化をリアルタイムで高解像度で撮影しながら、関門の狭さや密度を反映する電気抵抗も測定することは不可能に近い。
◆アンドレアス・ヒエールマンのもとで、モデナたちは3年半をかけて、開放型マイクロ流体3次元血液脳関門モデルを開発した。
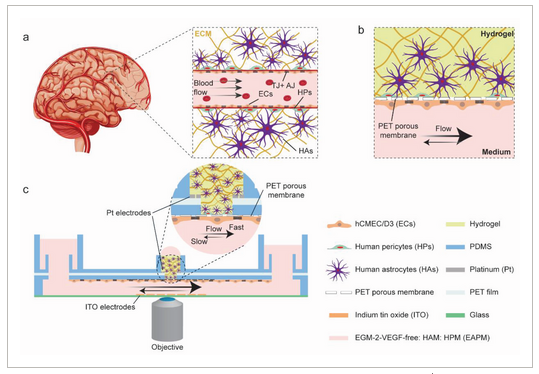
◆研究チームは、血液脳関門を再現するために、微小血管内皮細胞、ヒトアストロサイト、ヒト周皮細胞という、血液脳関門を自然に構成する細胞型を取り出し、単一のプラットフォーム内で結合させた。「この戦略により、人体で見られる3次元の細胞構造をほぼ完全に再現することができました」とModenaは言う。「しかし、本当に卓越しているのは、バリアの透過性を測定すると同時に、高解像度タイムラプス顕微鏡を使って、バリアの形態学的変化をマッピングできることです」。この二重の働きを促進するために、研究者達は、バリアの両側のガラスカバースリップに、完全に透明な電極を蒸着して、その透過性を測定しています。透明電極は、光学的検出や高解像度顕微鏡検査を妨げる可能性のある金属膜やワイヤー構造を含む他のタイプの電極と比較して、決定的な優位性を有している。
◆Advanced Science誌に最近掲載された研究で、研究者達は、彼らの新しいin vitro血液脳関門モデルを発表し、テストしています。研究者らは、脳卒中になったときに起こるような酸素・グルコース欠乏をこの関門に課した。「これらの実験により、バリアに急激な変化を起こすことができ、このプラットフォームの可能性を実証することができました」とModenaは語っている。
<関連情報>
- https://ethz.ch/en/news-and-events/eth-news/news/2023/02/achieving-a-better-understanding-of-how-the-blood-brain-barrier-works.html
- https://onlinelibrary.wiley.com/doi/10.1002/advs.202205752
バリア障害研究のための3次元血液脳関門モデル 3D In Vitro Blood-Brain-Barrier Model for Investigating Barrier Insults
Wei Wei, Fernando Cardes, Andreas Hierlemann, Mario M. Modena
Advanced Science Published: 13 February 2023
DOI:https://doi.org/10.1002/advs.202205752
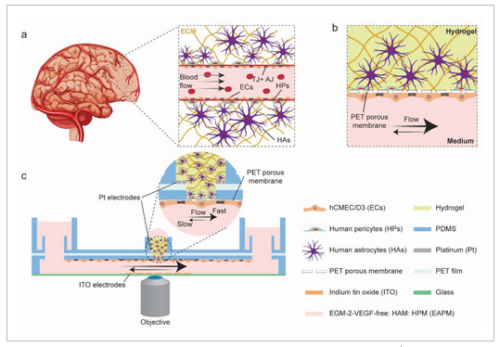
Abstract
Blood-brain-barrier (BBB) disruption has been associated with a variety of central-nervous-system diseases. In vitro BBB models enable to investigate how the barrier reacts to external injury events, commonly referred to as insults. Here, a human-cell-based BBB platform with integrated, transparent electrodes to monitor barrier tightness in real time at high resolution is presented. The BBB model includes human cerebral endothelial cells and primary pericytes and astrocytes in a 3D arrangement within a pump-free, open-microfluidic platform. With this platform, this study demonstrates that oxygen-glucose deprivation (OGD), which mimics the characteristics of an ischemic insult, induces a rapid remodeling of the cellular actin structures and subsequent morphological changes in the endothelial cells. High-resolution live imaging shows the formation of large actin stress-fiber bundles in the endothelial layer during OGD application, which ultimately leads to cell shrinkage and barrier breakage. Simultaneous electrical measurements evidence a rapid decrease of the barrier electrical resistance before the appearance of stress fibers, which indicates that the barrier function is compromised already before the appearance of drastic morphological changes. The results demonstrate that the BBB platform recapitulates the main barrier functions in vitro and can be used to investigate rapid reorganization of the BBB upon application of external stimuli.