2023-10-16 東京大学
発表のポイント
- これまで機能に謎の多かったタンパク質HMGA2がクロマチンを直接凝集させる活性を持つことを明らかにしました。
- クロマチンの凝集活性を持たない変異体HMGA2を作出することに成功し、HMGA2の凝集活性こそが神経幹細胞の維持に重要であることを見出しました。
- 今後、HMGA2の関与する個体発生やがん、細胞老化といった生命現象の理解に貢献することが期待されます。

本研究のまとめ(モデル)
発表概要
真核生物のゲノムDNAは、ヒストンタンパク質群に巻き付けられてヌクレオソーム(注1)と呼ばれる構造体を作り、このヌクレオソームが数珠状に連なることでクロマチン構造が形成されています。このクロマチンの凝集状態の違いによってゲノムDNAからの読み取りができるかどうかが決まるため、クロマチンの凝集状態の制御は極めて重要です。しかしながら、クロマチンを凝集させる因子はこれまで限られた数しか報告されていませんでした。
今回、東京大学大学院薬学系研究科の桑山尚大大学院生/特別研究員(研究当時)、後藤由季子教授(兼:ニューロインテリジェンス国際研究機構(WPI-IRCN) 主任研究者)らの研究グループは、同大学定量生命科学研究所の鯨井智也助教、胡桃坂仁志教授らとの共同研究により、これまで機能に不明な点が多かった因子HMGA2がクロマチンを直接凝集させる活性を持つことを明らかにしました。さらに、クロマチンの凝集活性を持たない変異体HMGA2を作出することで、HMGA2の凝集活性こそが神経幹細胞(注2)の維持に重要であることを見出しました。HMGA2は個体発生やがん、細胞老化といった現象に貢献することが知られるため、この研究はこれらの幅広い生命現象の理解につながることが期待されます。
発表内容
〈研究の背景〉
真核生物のゲノムDNAは、クロマチン構造をとって細胞核内に収納されています。クロマチンが凝集したところは遺伝子発現がオフになりやすく、逆に脱凝集したところは遺伝子発現がオンになりやすいことなどから、クロマチンの凝集状態は厳密に制御される必要があります。これまでの研究でいくつかの限られた因子がクロマチン凝集活性を持つことが報告されてきましたが、クロマチン凝集制御の多様さ・重要さを考えると他にも凝集に関わる因子が存在する可能性が考えられます。そこで本研究ではHMGA2というクロマチン因子に着目しました。
これまで本グループを含めたいくつかのグループが、HMGA2が神経幹細胞の維持に貢献することを明らかにしてきました。この他にもHMGA2は個体発生やがん、細胞老化といった幅広い生命現象に寄与することが知られています。しかしながら、HMGA2がクロマチン構造に与える影響については間接的な観察に基づいた報告にとどまっており、HMGA2がクロマチン構造に与える直接的な影響は不明でした。
〈研究内容〉
本研究チームはHMGA2が既知のクロマチン凝集因子H1と相互作用することを発見したことをきっかけに、HMGA2がクロマチン構造を直接制御する可能性を考えました。そこで精製したHMGA2とポリヌクレオソームを用い、生化学的な解析や原子間力顕微鏡(注3)による観察を行うことでHMGA2がクロマチン構造に与える影響を解析しました。その結果、HMGA2を加えることでポリヌクレオソームが凝集する様子が観察され、HMGA2はクロマチンを直接凝集させる活性があることを初めて明らかにしました。
この結果と一致して、次世代シーケンス解析(注4)、イメージング解析を用いることで、HMGA2は生体内においても凝集したクロマチンに存在することを見出しました。さらにHMGA2の遺伝子内部への結合は遺伝子発現の抑制と関連すること、またHMGA2は液液相分離を起こすこと、なども発見しました。以上の結果からHMGA2はこれまでに知られていなかったクロマチン凝集因子であることが分かりました。
さらに筆者らはHMGA2によるクロマチン凝縮がHMGA2の生理機能に貢献しているのかを検証しました。そこで、クロマチン凝縮の性質を欠失したHMGA2変異体の作成を試みました。その結果、HMGA2の一部であるhookドメインを欠失させることで、ヌクレオソームへの結合活性を維持したままHMGA2の凝集活性が失われることを明らかにしました。そこでこのhook欠失変異体を用いて、HMGA2のクロマチン凝集活性が、どのような細胞機能に貢献するか検証しました。
先述のように、本グループはこれまでにHMGA2が胎生期に神経幹細胞の維持に貢献していることを明らかにしてきましたが、この機能がクロマチン凝集活性に依存しているかは不明でした。そこで全長およびhook1を欠損しクロマチン凝集活性を失ったHMGA2変異体を子宮内電気穿孔法(注5)によって胎生期大脳新皮質に強制発現したのち、神経細胞の運命を検証しました。この結果、全長のHMGA2を強制発現した場合、分裂を続ける神経前駆細胞の割合が増加したのに対し、hook1を欠損したHMGA2の過剰発現ではこの効果は見られませんでした。重要なことに、クロマチン凝集活性を失ったhook1欠損HMGA2に対して強制的に凝集を誘導した場合、全長のHMGA2の過剰発現と同様に神経幹細胞の維持効果がみられました。このことから、HMGA2による神経幹細胞の維持効果はクロマチン凝集活性に依存していることが分かりました。
〈今後の展望〉
これまで長年の研究にも関わらず、クロマチンを直接凝集する活性のあるタンパク質はいくつかの有名因子に限られてきました。本研究はクロマチン凝集因子のリストに新しくHMGA2を加えたという点で大きな意義があります。また本研究ではHMGA2の凝集活性こそがHMGA2による神経幹細胞の維持という生理的機能に重要であることを見出しました。HMGA2は個体発生やがん、細胞老化といった生命現象に寄与することが知られています。本研究はこれらの幅広い現象の理解、ひいては疾患の治療法の確立につながることが期待されます。
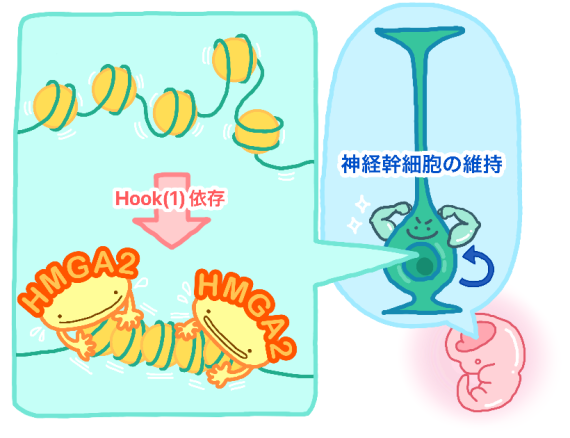
図:本研究のモデル
HMGA2はhook(1)ドメイン依存的にクロマチンを直接凝集させる活性を持つこと、このクロマチン凝集活性こそがHMGA2による神経幹細胞の維持に重要であることを見出しました。
発表者
東京大学大学院薬学系研究科
桑山 尚大(研究当時:博士課程/日本学術振興会特別研究員)
後藤 由季子(教授/東京大学国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN)主任研究者)
東京大学定量生命科学研究所
胡桃坂 仁志(教授)
論文情報
〈雑誌名〉Nature Communications
〈論文タイトル〉HMGA2 directly mediates chromatin condensation in association with neuronal fate regulation
〈著者〉Naohiro Kuwayama, Tomoya Kujirai, Yusuke Kishi, Rina Hirano, Kenta Echigoya, Lingyan Fang, Sugiko Watanabe, Mitsuyoshi Nakao, Yutaka Suzuki, Kei-ichiro Ishiguro, Hitoshi Kurumizaka and Yukiko Gotoh
〈DOI〉 10.1038/s41467-023-42094-9
〈URL〉 https://www.nature.com/articles/s41467-023-42094-9
研究助成
本研究は、科学研究費補助(JP21J14115, JP22K15033, 16H06279, 20H03179, 21H00242, 22H04687, 20K07589, JP20H00449, JP18H05534, JP22H00431, JP16H06279 and JP22H04925)及び日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」研究開発領域における研究開発課題「胎児における神経幹細胞の制御はいかにして生後脳の発達と自閉症様行動に影響するか」(研究代表者:後藤由季子) の支援により実施されました。
用語解説
(注1)ヌクレオソーム
4種類のコアヒストンからなる複合体にDNAが巻き付いた安定な構造体です。
(注2)神経幹細胞
中枢神経系を構成するニューロンや、アストロサイト、オリゴデンドロサイトなどのグリア細胞を産み出す幹細胞です。ニューロンは脳での情報伝達を行う細胞で、アストロサイトは主にその機能をサポートする役割がありますが、どちらも脳の機能に重要な細胞種です。
(注3)原子間力顕微鏡
走査型プローブ顕微鏡の一種で、探針によって試料表面上をなぞることで資料の形状をナノスケール分解能で解析できる顕微鏡です。
(注4)次世代シーケンス解析
大量のDNA断片の配列を決定する機械です。本研究ではHMGA2の特異的抗体を用いてHMGA2に結合しているDNAを回収し、その配列を決定することでHMGA2の結合領域を明らかにしました。
(注5)子宮内電気穿孔法
子宮内のマウス胎児の脳室内にプラスミドDNAを注入し、外部から局所的に電気刺激を与えることで神経細胞に遺伝子を導入する手法です。
問合せ先
〈研究に関する問合せ〉
東京大学大学院薬学系研究科
教授 後藤 由季子(ごとう ゆきこ)
〈報道に関する問合せ〉
東京大学大学院薬学系研究科 庶務チーム
東京大学国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN) 広報担当