2024-01-10 東京大学
発表のポイント
- 3次元的に培養された細胞モデルの3次元画像を高速・大量に取得・解析するプラットフォームを開発しました。
- 1分あたり28,117個の細胞の計測を達成し、既存手法を約10倍上回る、世界最速の3次元培養モデルの流体中3次元計測を実現しました。
- 高速・大量の計測が欠かせない創薬や幹細胞の品質管理など、幅広い生物医科学の分野に比類ない速度と規模で、大きな貢献をすることが期待されます。
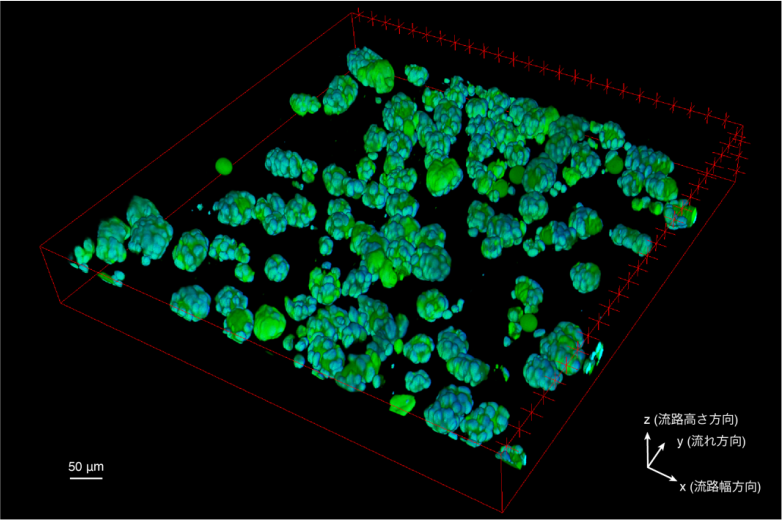
1秒間に計測された3次元細胞培養モデル
概要
東京大学先端科学技術研究センターロボティック生命光学分野の太田禎生准教授、服部一輝特任助教、玉光未侑特任助教らの研究グループは、3次元細胞培養モデル(注1) の3次元画像を高速かつ大規模に、流体中で取得・解析可能なプラットフォームを開発しました。
3次元細胞培養モデルは、生体内での細胞の機能をより正確に再現可能であるため、生物医科学の分野で幅広く用いられています。しかし、大量の3次元細胞培養モデルの3次元画像を高速・大量に取得するのは容易ではありませんでした。そこで本研究では、ライトシート顕微鏡(注2)と音響流体力学(注3)の技術を組み合わせることで、1分あたり28,117個の細胞という世界最速・最大規模での3次元培養モデルの3次元計測と、形態情報の定量的解析を実現しました。本技術は、高速・大量の計測が重要な、創薬スクリーニングや、幹細胞の品質管理といった幅広い生物医科学分野において、大きな貢献をすることが期待されます。
本研究成果は、国際雑誌「Small Methods」(2023年12月22日)にオンライン掲載されました。
ー研究者からのひとことー
この研究は、光学、細胞工学、ハイドロゲル工学、流体工学という多様な専門性を要しており、異分野の研究者の密な協働によって強力技術の開発に至りました。ご支援して下さった皆様に心から感謝を申し上げます。この技術は微小ハイドロゲルビーズにて培養した複数細胞を観察単位とし、現象を高精度かつ高速・大量に解析します。多様な進化が進んでおり、AIや光学解析技術を発展させ、生命科学、医薬分野へ応用します。(太田禎生准教授)
発表内容
3次元細胞培養モデルは、細胞が生体内で有していた本来の機能をより正確に再現可能であるため、生物医科学研究において不可欠な手法となっています。また、3次元細胞培養モデルを作成するためには、細胞が接着することで、増殖・分化し、機能を発揮できるような足場が重要です。数ある足場用素材の中で、ハイドロゲルビーズ(注4)は、細胞の接着面積を増やし、細胞への栄養と酸素の効率的な供給が可能で、細胞製品の大量生産にも有用であることから、広く用いられています。
一方で、例えば薬剤試験のように、大量の3次元細胞培養モデルを評価する必要がある研究では、高速・大量に3次元画像を取得する技術が必要ですが、従来法は計測に時間がかかり、また規模は顕微鏡上の容器の大きさに制限されるケースが多く、実応用には速度・規模ともに限界がありました。
そこで、本研究ではハイドロゲルビーズ上で培養した3次元細胞培養モデルの、高速・大規模な3次元画像を取得可能な3次元イメージングフローサイトメトリー(注5)プラットフォームを開発しました(図1)。具体的には、まず、ハイドロゲルビーズ上で接着細胞を培養し球状構造を形成し、そのサンプルを微小流体デバイス内に流します。サンプルの流れる位置を音響流体力学の手法を用いてコントロールし、ライトシート顕微鏡により対象の2次元切断面像を連続して計測することで、歪みのない3次元画像を取得しました。最後に、その3次元画像を解析することで、2次元の画像で得られるものよりも精細に、個々の細胞の形の特徴について定量的評価を行いました。
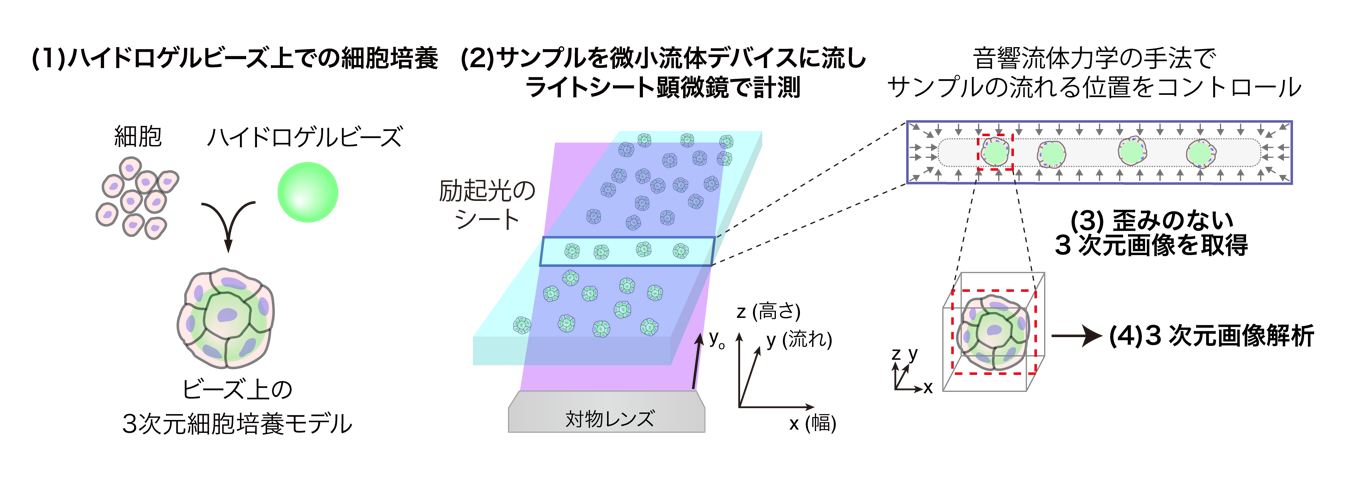 図1:本研究のワークフロー
図1:本研究のワークフロー
ハイドロゲルビーズ上で培養した3次元細胞培養モデルを、微小流体デバイスに流し、音響流体力学の手法で流れる位置をコントロールした同モデルの2次元切断画像を、ライトシート顕微鏡で連続計測することで、歪みのない3次元画像を取得した。最後に、3次元画像解析によって定量的評価を行った。
以上のプラットフォームを用いることで、本研究では1分あたり28,117個の細胞(1,310個の3次元細胞培養モデル)という世界最速の流体中計測を実現しました。さらに、本手法の生物学的な応用例として、ビーズ上で3次元培養された接着状態の細胞と、足場から剥離した浮遊状態の細胞の核形態の比較解析を、大規模に実施しました。42,175個もの接着状態の細胞の核形態を解析することに成功し、浮遊状態の細胞と比べて、接着状態の細胞の核は小さく複雑な形をしていることなどを明らかにしました(図2)。

図2:3次元細胞培養モデルとライトシート顕微鏡での計測画像、および浮遊状態と接着状態での定量的比較の結果例
(左図)ハイドロゲルビーズ上で培養した細胞の2次元画像。ライトシート顕微鏡ではなく、通常の蛍光顕微鏡で撮影したもの。
(中図)ライトシート顕微鏡で連続計測したハイドロゲルビーズと細胞膜の2次元切断面像。
(右図)浮遊状態と接着状態での細胞核の体積の比較。
本技術は、核形態のみならず細胞の様々な3次元的特徴の評価や、がん組織や臓器のモデルのような幅広い3次元細胞培養モデルへ応用することが可能です。したがって、薬剤の候補や病気の原因遺伝子の発見、細胞療法に用いられる幹細胞の評価など、生物医科学研究に大きな貢献をすると期待されます。
発表者・研究者等情報
東京大学 先端科学技術研究センター ロボティック生命光学分野
太田 禎生(准教授)
服部 一輝(特任助教)
玉光 未侑(特任助教)
桐浴 裕巳(学術専門職員)
東京大学 大学院工学系研究科 先端学際工学専攻
山下 港 博士課程
陈 骁尧(チェン シャオヤオ)(博士課程)
論文情報
- 雑誌:Small Methods(12月22日)
- 題名:High-throughput 3D imaging flow cytometry of suspended adherent 3D cell cultures
- 著者:Minato Yamashita, Miu Tamamitsu, Hiromi Kirisako, Yuki Goda, Xiaoyao Chen, Kazuki Hattori*, Sadao Ota*
*責任著者 - DOI:10.1002/smtd.202301318
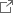
研究助成
本研究は、科学技術振興機構(JST)CREST「多次元・ネットワーク化計測による細胞外微粒子の多様性と動態の解明(課題番号:JPMJCR19H1)」、科研費「ゲノム編集iPS細胞を用いた超網羅的表現型解析法の開発(課題番号:JP21H04636)、接着シンギュラリティ細胞の動態から分子まで捉えるネットワーク化計測(課題番号:JP21H00416)、三次元形態計測に基づく、ベージュ脂肪細胞への分化運命予測(課題番号:JP22K12797)」、日本医療研究開発機構(AMED)PRIME「老化腸幹細胞ニッチを大量・並列に再現し、ニッチ内コミュニケーションを解く(課題番号:JP22gm6710008)」などの支援により実施されました。
用語解説
(注1)3次元細胞培養モデル
3次元空間中に広がった状態で培養された細胞集団。これまで一般的に用いられてきた2次元平面上での培養に比べて、より生体に近い環境で細胞を培養可能なため、生体内で本来持っていた機能を発揮しやすいとされる。
(注2)ライトシート顕微鏡
薄いシート状の励起光を照射することで、サンプル断面の顕微鏡像を得る。シートと対象の相対的位置を変化させることで、連続的に2次元断面像を撮影し、高速にサンプルの3次元画像を得ることができる。
(注3)音響流体力学
音波を利用して流体中の微小な物体を操作する技術。流体中の細胞の位置などを精密に制御できる。
(注4)ハイドロゲルビーズ
ポリマーのネットワークからなり、水分を保持できるハイドロゲルからできた微小な粒子。様々な形や材質を選択し、設計できる。
(注5)イメージングフローサイトメトリー
細胞を流体中に流しながら高速に計測する技術であるフローサイトメトリーの中でも、画像情報を取得できるもの。2次元や3次元空間の画像情報をより高速に取得できる技術の開発が進んでいる。
問合せ先
東京大学 先端科学技術研究センター ロボティック生命光学分野
准教授 太田 禎生(おおた さだお)