2018-09-14 広島大学,鳥取大学,自然科学研究機構 基礎生物学研究所
【本研究成果のポイント】
新規モデル動物イベリアトゲイモリ※1とゲノム編集ツールであるCRISPR-Cas9※2を組み合わせることにより迅速かつ高効率な発生再生遺伝子の機能解析法を確立しました。
本解析法を用いて、器官発生において中心的な役割を果たすソニックヘッジホッグ遺伝子※3の転写調節領域※4の中に、四肢再生にも重要な配列があることを明らかにしました。
本研究の成果は、有尾両生類であるイモリの高い器官再生能力や、ヒトの疾患に関与する遺伝子の機能を解明するためのツールやヒントとなり、今後の再生医療研究への貢献が期待されます。
【概要】
有尾両生類であるアホロートルやイモリは、失ったり傷ついたりした組織や器官を元通りに修復する非常に高い器官再生能力を持っており、古くから生物学において注目されてきました。しかしながら、飼育繁殖が難しく、効率的な遺伝子機能解析の方法が未確立であったことから、その高度な器官再生能力の秘密に迫ることは困難でした。そこで、広島大学大学院理学研究科(基礎生物学研究所)の鈴木賢一特任准教授、鳥取大学医学部の林利憲准教授、基礎生物学研究所、学習院大学、京都大学らの研究グループは、飼育に手間がかからず性成熟が早い、新規モデル動物であるイベリアトゲイモリとゲノム編集ツールの一つであるCRISPR-Cas9を用いて、極めて高効率な遺伝子破壊動物(ノックアウトイモリ)作出による遺伝子機能解析法を確立しました。この技術を用いて、迅速に眼や心臓の発生に重要な遺伝子の機能を解析することができました。さらには、器官発生に中心的な役割を果たすソニックヘッジホッグ遺伝子の転写調節領域の一部に、四肢が再生する際にも重要な機能があることを明らかにしました。
本研究成果は、2018年9月10日(米国時間)に米国科学誌「Developmental Biology」に掲載されました。
【背景】
有尾両生類であるアホロートルやイモリは、失われたり傷ついたりした組織や器官を元通りに修復する、非常に高い器官再生能力を持っています。この再生能力の秘密を解明すれば、ヒトの傷ついた組織を治療したり、試験管内で人工器官を作り出すための重要なヒントが得られるはずです。
現在、世界中で多くの生命科学者が有尾両生類の再生能力を解明しようと研究しています。しかしながら、アホロートルやこれまで使用されてきたイモリは、餌付けや飼育に手間がかかり、性成熟するまで成長させるには多くの労力と時間が必要です。また、簡便で高効率な遺伝子機能解析法がこれまで確立されておらず、逆遺伝学的手法を用いた再生研究は他のモデル生物に比べて立ち遅れていました。そこで複数の研究グループとの共同で、飼育や繁殖が容易なイベリアトゲイモリに注目し、新しい実験(モデル)動物として実用化を進めてきました。
【研究成果の内容】
本研究グループは、このイベリアトゲイモリの受精卵にCRISPR-Cas9タンパク質を顕微注入することにより、遺伝子破壊(ノックアウト)動物を作出しました。CRISPR-Cas9タンパク質を顕微注入された個体を次世代シークエンサーで解析した結果、体を構成しているほとんどの細胞(最大100%)において、標的遺伝子のノックアウトが起こっていることが判明しました。これは、子孫を取る必要なく、当世代(顕微注入した個体)のイモリで迅速な遺伝子機能解析が可能であることを意味しています。実験例として、色素合成、眼の形成、心臓の形成に重要な発生関連遺伝子を標的にした結果、ほぼ全ての個体において予想通りのノックアウト表現型が確認されました。このノックアウトイモリは実験を始めてからたった一週間で作出することができます。さらには、ノックアウトした当世代のイモリを性成熟させて、一年以内に子孫(すでにノックアウトされている)を得ることにも成功し、このイモリを用いた本格的な逆遺伝学※5が可能であることを示しました。
さらには、器官発生に中心的な役割を果たすソニックヘッジホッグ遺伝子の転写制御領域の一部を破壊したところ、四肢が再生する際にも重要な配列があることを明らかにしました。
【今後の展開】
イベリアトゲイモリとCRISPR-Cas9を組み合わせることにより、イモリの器官再生能力に関与する遺伝子や疾患に関与する遺伝子を個体レベルで迅速かつ簡便に解析することが可能となりました。加えて、我々が作成したノックアウトイモリから得た知見は、器官再生の鍵を握るソニックヘッジホッグ遺伝子の転写調節機構を解明する手がかりとなります。このように本成果で得られたツールや知見は、再生医療研究への大きな貢献が期待されます。
【用語の解説】
※1イベリアトゲイモリ
イベリア半島原産のイモリの一種で学名はPleurodeles waltl。飼育が容易で、一年以内に性成熟(卵や精子を作ることができる雄雌個体になること)し、ホルモン注射により一年中受精卵を得ることが可能な動物。
※2 CRISPR-Cas9
ゲノム編集技術において最も利用されている人工DNA切断酵素の一つ。Clustered regularly interspaced short palindromic repeats- CRISPR associated protein 9の略。
※3ソニックヘッジホッグ遺伝子
動物の器官発生において中心的な役割を担う分泌性タンパク質遺伝子の一つ。動物の器官再生においても重要であることが知られている。
※4転写調節領域
遺伝子の転写をon/offするために重要な、いわばスイッチの役割をはたすゲノム上の配列のこと。本研究では、ソニックヘッジホッグ遺伝子の四肢特異的転写調節領域のある部分配列を破壊した。
※5逆遺伝学
特定遺伝子を破壊(ノックアウト)し、得られた表現型(形質)からその機能を解析する方法。次世代シークエンサーとゲノム編集技術の発展によりモデル生物だけでなく、多くの生物で行えるようになってきた。

図1:イベリアトゲイモリ野生型(右)と色素合成遺伝子(左)をノックアウトした個体。ノックアウトした個体はメラニン色素が合成できない。当世代で多数のノックアウトイモリを作ることができる。
 図2:色素合成遺伝子ノックアウトイモリは生後一年以内に性成熟し、子孫を取ることができるため、逆遺伝学的な研究が可能となった。
図2:色素合成遺伝子ノックアウトイモリは生後一年以内に性成熟し、子孫を取ることができるため、逆遺伝学的な研究が可能となった。
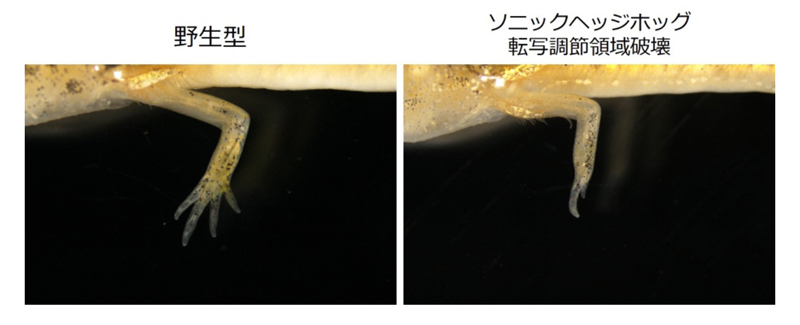 図3:ソニックヘッジホッグ遺伝子の四肢特異的転写調節領域の一部を破壊した個体の再生後の前肢。野生型は元通り(4本指)に再生するのに対し、転写調節領域を破壊した個体は指の本数が少なくなる。
図3:ソニックヘッジホッグ遺伝子の四肢特異的転写調節領域の一部を破壊した個体の再生後の前肢。野生型は元通り(4本指)に再生するのに対し、転写調節領域を破壊した個体は指の本数が少なくなる。
【論文に関する情報】
タイトル
“Cas9 ribonucleoprotein complex allows direct and rapid analysis of coding and noncoding regions of target genes in Pleurodeles waltl development and regeneration”
著者名
Miyuki Suzuki1, Toshinori Hayashi2*, Takeshi Inoue3, Kiyokazu Agata3、4, Miki Hirayama4, Miyuzu Suzuki5, Shuji Shigenobu5, Takashi Takeuchi2, Takashi Yamamoto1, and Ken-ichi T. Suzuki1、5*
所属:
1.広島大学大学院理学研究科
2.鳥取大学医学部生命科学科
3.学習院大学理学部
4.京都大学理学研究科
5.基礎生物学研究所
*: 責任著者
掲載誌
米国科学誌Developmental Biology
DOI:
https://doi.org/10.1016/j.ydbio.2018.09.008
【お問い合わせ先】
広島大学大学院理学研究科数理分子生命理学専攻分子遺伝学研究室
基礎生物学研究所新規モデル生物開発センター(クロスアポイントメント)
特任准教授 鈴木 賢一
鳥取大学医学部生命科学科生体情報機能学講座生体情報学分野
准教授 林 利憲