2024-10-17 早稲田大学
発表のポイント
- 遺伝子DNAからメッセンジャーRNAが作られる転写反応で、転写が途中で誤って停止するために異常メッセンジャーRNAが作られています。このような異常メッセンジャーのうち、最終エキソンが3’側のイントロンまで伸長したタイプを3XTと名付けました。
- 3XTの発生を監視して除去するために、核内RNA分解を制御するMTR4タンパク質とRNAに結合するhnRNPKタンパク質が協力していることを発見し、3XTを除去できないと3XTから異常な病的タンパク質が生産され、この病的タンパク質が細胞内に病的構造物を作ることを見いだしました。すなわち、病的構造体形成を阻害するRNA品質管理機構が細胞核内に存在していることを明らかにしました。
- 本成果は、RNA品質管理機構を標的とした薬剤の開発や疾患の治療法の発展に貢献すると期待されます。

RNAプロセシング異常による異常RNA生成と異常構造体形成
概要
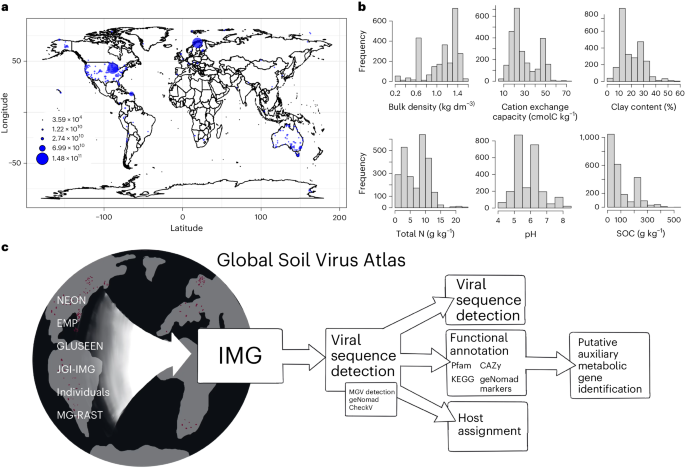
東京大学アイソトープ総合センターの秋光信佳教授、谷上賢瑞特任准教授、早稲田大学理工学術院の浜田道昭教授、曽超研究院講師、東京大学大学院新領域創成科学研究科の鈴木穣教授、関真秀特任准教授らによる研究グループは、RNAヘリカーゼMTR4(注1)がRNA結合タンパク質hnRNPK(注2)と協調し、転写反応中に起きるRNAプロセシング(注3)の制御異常で生じる異常RNA群(3XT,注4)を分解していることを明らかにしました。また、KCTD13 遺伝子座から発現するKCTD13 3XTの翻訳産物が、相分離(注5)制御を介して異常な構造体KeXT body(注6)を形成していることを見出しました(図1)。
本研究では、ナノポアシークエンサー(注7)を用いたdirect RNA sequencing技術(注8)を用いることで3XTの発見に繋がりました。異常RNAを分解することで、異常RNA翻訳産物の異常構造体形成を阻害するRNA品質管理機構が存在していることが明らかになり、この研究成果は様々な疾患の診断/治療法開発の重要な基盤となることが期待されます。

図1:KCTD13 3XT翻訳産物は、MTR4非存在下においてKeXT bodyを形成する
発表内容
RNAプロセシングは、キャップ構造の付加、スプライシング、ポリA付加など複数のプロセスによって、転写されたRNAを成熟したmRNAに変換する過程です。これらの制御異常は、異常タンパク質の産生に繋がり、がんや神経疾患など、多くの疾患に関与することが知られています。一方、細胞にはRNAが転写されて成熟mRNAに変化するまでを管理する仕組み(Surveillance system)が存在しており、異常RNAを識別して、適切に分解・排除しています。核内RNA分解機構は、RNA分解を担当するRNAエキソソーム複合体(注9)とRNA識別を担うRNAヘリカーゼMTR4によって形成されており、主に転写直後の単独エキソン転写産物を分解することが知られていました。しかし、RNAプロセシングの制御異常によって生じた複数のエキソンを持つ異常RNAの分解機構は明らかになっていませんでした。
本研究グループはまず、RNAプロセシングの破綻によって生じる異常RNAの分解機構に着目し、従来のRNAシークエンスに加え、RNA全長構造を可視化するdirect RNAシークエンスとポリアデニル化部位を検出する3’末端シークエンス(注10)を実施しました。結果、ポリアデニル化の脱制御により転写が途中で終結し、最終エキソンが3’側のイントロンまで伸長した異常RNAである3XTをMTR4が分解していることを見出しました。
続いて本研究グループは、単独エキソンであるmono-exon 3XTと、スプライシング制御を受け複数のエキソンを持つmulti-exon 3XTに3XTを分類(図2)し、分解機構が明らかになっていないmulti-exon 3XTに着目して研究を進めました。multi-exon 3XTの伸長領域(3XR: 3’ eXtended Region, 図2)に対してモチーフ解析を行ったところ、hnRNPKが当該3XRsに結合している可能性を見出しました。そこでhnRNPKの発現を抑制すると、multi-exon 3XTsの発現が増加することを発見しました。本研究グループはさらに研究を進め、hnRNPKはmulti-exon 3XTの3XRに結合し、RNAエキソソーム-MTR4複合体を当該3XTにリクルートすることで、multi-exon 3XTを分解する仕組みを見出しました。
最後に、MTR4によって制御される3XTsから生成される異常な翻訳産物が異常構造体を形成するのかを調べました。まず構造体形成予測を行い、KCTD13遺伝子座から発現するKCTD13 3XT由来タンパク質が、相分離を起こす可能性を有するペプチド配列を有しており、構造体を形成する可能性を見出しました。そこで、KCTD13 3XTタンパク質に対する抗体を作成し、MTR4を発現抑制したヒト子宮頸がん細胞株HeLa細胞における局在を確認したところ、KCTD13 3XTタンパク質が相分離制御を介して異常な病的構造体KeXT bodyを形成することを見出しました。
これらの結果から、RNAプロセシング異常を有する異常RNAを分解することで、異常RNAから翻訳されたタンパク質による病的構造体の形成を阻害するRNA品質管理機構が存在していることが明らかとなりました。これはRNA品質管理機構の破綻による病的構造体形成が様々な疾患を引き起こす可能性を示唆しており、様々な疾患に対するRNA品質管理機構を標的にした治療法の発展に寄与することが期待されます。

図2:3XT及び3XRの定義
発表者・研究者等情報
東京大学
アイソトープ総合センター
秋光 信佳 教授
谷上 賢瑞 特任准教授
Han Han 研究当時:博士課程
大学院新領域創成科学研究科
鈴木 穣 教授
関 真秀 特任准教授
早稲田大学
理工学術院
浜田 道昭 教授
曽 超 次席研究員 (研究院講師)
論文情報
雑誌名:Nature Communications
題 名:The MTR4/hnRNPK complex surveils aberrant polyadenylated RNAs with multiple exons
著者名:Kenzui Taniue*, Anzu Sugawara, Chao Zeng, Han Han, Xinyue Gao, Yuki Shimoura, Atsuko Nakanishi Ozeki, Rena Onoguchi-Mizutani, Masahide Seki, Yutaka Suzuki, Michiaki Hamada, Nobuyoshi Akimitsu*
DOI: 10.1038/s41467-024-51981-8
URL: https://www.nature.com/articles/s41467-024-51981-8
用語解説
(注1) MTR4
RNAヘリカーゼMTR4(MTREX)は、核内に局在し、RNAエキソソームのアクセサリータンパク質として機能する。RNA結合タンパク質と結合して様々な複合体を形成し、それぞれ特定の標的RNA群を識別する。また、MTR4はスプライシング機構にも関与することが知られており、多機能タンパク質として様々な局面で機能することが知られている。
(注2) hnRNPK
hnRNPKは、核に局在するDNA/RNA結合タンパク質であり、様々な生物学的プロセスを制御する。hRNPKの発現異常は、癌などの疾患の発症に関与する。hnRNPKは、RNAや一本鎖DNAを認識する3つのKHドメイン、核局在化シグナル、核シャトリングドメインを有しており、転写、mRNAスプライシング、RNAの輸送、翻訳などに関与することが知られているが、hnRNPKが核内RNA分解に関与していることは報告されていない。
(注3) RNAプロセシング
RNAプロセシングとは、細胞内で合成されたRNA分子が機能的な成熟RNAに変換される過程のこと。RNA ポリメラーゼ Ⅱによる転写反応で前駆体 mRNA(pre-mRNA)が合成されると、5’末端キャッピング,スプライシング,3’末端プロセシングなど様々なプロセシング反応により成熟 mRNA となる。また、選択的RNAスプライシングや選択的ポリA付加によって、遺伝子特異的かつ細胞型特異的にRNAアイソフォームを生成される。選択的RNAスプライシングや選択的ポリA付加は、タンパク質多様性の獲得に寄与し、多様な生理的条件下で細胞プロセスを制御する上で重要な役割を果たしている。
(注4) 3XT (3’ eXtended Transcript)
ポリアデニル化の脱制御により転写が途中で終結し、最終エキソンが3’側のイントロンまで伸長した異常RNAのこと。3XTは本研究グループが発見し、第1エキソンが伸長した3XTをmono-exon 3XT、2つ目以降のエキソンが伸長した3XTをmulti-exon 3XTと命名した。従来のエキソンからイントロンまで伸長した領域を3XR (3’ eXtended Region)と命名した。図2参照。
(注5) 相分離
相分離は、生物学において重要なプロセスであり、特定の条件下で細胞内の分子が自発的に分離し、異なる相(phase)を形成する現象を指す。このプロセスによって細胞内の特定の区域に分子が集中し、高次構造体やゲルのような凝集体を形成することで、効率的な生化学反応や転写や翻訳などの調節機構を効果的に実行することが可能となる。近年、相分離が多くの生物学的過程において重要な役割を果たしていることが示されており、相分離の異常によってがんや神経変性疾患の発症に繋がる可能性が示唆されている。
(注6) KeXT body (KCTD13 3eXtended Transcript-derived protein body)
KCTD13遺伝子座から発現するKCTD13 3XTの翻訳産物が形成する異常構造体のこと。KeXT bodyは主に細胞質で構成されるが、その構成因子や機能についてはまだ不明である。
(注7) ナノポアシークエンサー
細胞膜に存在するタンパク質を用いたナノスケールの孔(ナノポア)を使って、DNAやRNAの塩基配列を直接読み取る技術を用いたシークエンサーのこと。ナノポアシークエンサーは、他のシーケンシング技術と比べて非常に長いリード(数万塩基に及ぶことも可能)を読み取ることができ、複雑なゲノム領域や構造変異、RNAの全長構造の解析などの解析が可能になる。また、DNAだけでなく、RNAも直接シークエンスできるため、転写後修飾の研究にも利用されている。
(注8) direct RNA sequencing技術
ナノポアシークエンシング技術によるRNA分子を直接シークエンスする技術のこと。RNA分子がナノポアを通過する際に、各塩基(A、U、C、G)の違いによって生じる電流の変化をリアルタイムで検出し、電流の変化パターンを解析することで、RNAの塩基配列が決定する。cDNA合成やPCR増幅などのステップを経ずに、RNAを直接シークエンスすることで、PCRバイアスや逆転写エラーを回避することが出来る。
(注9) RNAエキソソーム複合体
RNAエキソソーム複合体は、真核細胞の核内でRNAの分解やプロセシングに重要な役割を果たすタンパク質複合体のこと。RNAエキソソームは、9つのタンパク質(EXOSC1 – EXOSC9)から構成されるRNA分解活性を持たないエキソソームバレルとRNA分解活性を有するDIS3やEXOSC10から成る。多くのRNA分子を対象とし、主に不必要なRNAや異常なRNAの分解を行う。RNAエキソソーム複合体の制御異常は、がんや神経変性疾患の様々な疾患と関連することが知られている。
(注10) 3’末端シークエンス
3’末端シークエンスは、RNA分子の3’末端に付随するポリ(A)テールを利用して、遺伝子の転写物の末端部分を標識し、3’末端部分をシークエンスする技術。主に、遺伝子発現解析や3’UTRアイソフォームの存在量を測定するために用いられる。通常の全長RNA-seqと比較して、解析に必要なリード数が少なくて済むため、低コストでの発現解析が可能である。また、RNA量が少なくても高感度かつ高精度に発現解析を行うことができるので、遺伝子発現解析、ポリAテール解析、RNA安定性解析に加え、シングルセル解析などにも応用されている。
研究支援
本研究は、科研費「自然免疫応答を制御する長鎖非コードRNAに関する研究(課題番号:17KK0163)」、「リピート要素のde novo発見に基づく長鎖ノンコーディングRNAの機能の解明(課題番号:20H00624)」、「核内RNAボディによるクロマチン制御と熱ストレス応答(課題番号:21H00243)」、「ヒト細胞における新しい物理化学的ストレス感知・応答機構の解明と癌治療への応用(課題番号:21H04792)」、「lncRNA-RBP複合体によるユビキチン-プロテアソーム制御機構(課題番号:21H02758)」、「RNA品質管理機構によるイントロン-エクソン化RNA生成と癌維持機構への関与(課題番号:21K19402)」、「膵癌オルガノイドを用いた構造異常RNAの探索と機能解析(課題番号:22KK0285)」、「先進ゲノム解析研究推進プラットフォーム(課題番号:22H04925)」、「Identification of repetitive elements involving genome regulation(課題番号:22K15093)」、「RNAを中心とした分子ネットワークに基づく生物学的相分離の俯瞰的・体系的理解(課題番号:23H00509)」、「生殖ライフスパンにおける RNAキネティクス計測(課題番号:23H04955)」、AMED「機能解析に基づく RNA 標的創薬のための統合 DB と AI システムの構築(課題番号:JP21ae0121049)」、上原記念生命科学財団、武田科学振興財団、小林財団、MSD生命科学財団、内藤記念科学振興財団、小野医学研究財団、ノバルティス科学振興財団の支援により実施されました。