2020-05-27 理化学研究所,大阪市立大学,ニューカッスル大学,IVFなんばクリニック
理化学研究所(理研)生命機能科学研究センター染色体分配研究チームの吉田周平上級研究員、橋本周客員研究員(大阪市立大学大学院医学研究科特任准教授、IVFなんばクリニック研究部長)、北島智也チームリーダー、ニューカッスル大学のメアリー・ハーバート教授、IVFなんばクリニックの中岡義晴院長らの国際共同研究グループは、マウスの卵母細胞[1]では、染色体分配を担う紡錘体[2]形成の際に、染色体上の動原体[3]が「土台」として機能するものの、ヒトの卵母細胞では機能しないことを発見しました。
本研究成果は、ヒト卵子で高頻度に見られる染色体数異常の原因の理解につながると期待できます。
卵子[1]が正確につくられるためには、卵母細胞の減数分裂[4]時に二つの極を持つ紡錘体が形成され、それぞれの極に向かって正しい数の染色体が分配される必要があります。多くの動物の体細胞分裂では、中心体[5]が紡錘体の二極性の土台として働きます。しかし、哺乳類の卵母細胞は中心体を持たないことから、紡錘体を形成するための土台が何かはよく分かっていませんでした。
今回、国際共同研究グループは、マウス卵母細胞で二極性の紡錘体が形成されるためには、Ndc80[3]とPrc1[6]の二つのタンパク質が染色体上の動原体で機能する必要があることを発見しました。そして、この動原体を土台とする機構はマウス卵母細胞でのみ働き、正しく卵子に染色体を分配するために必須である一方、ヒト卵母細胞では働かないことが分かりました。
本研究は、オンライン科学雑誌『Nature Communications』(5⽉27⽇付︓⽇本時間5⽉27⽇)に掲載されます。
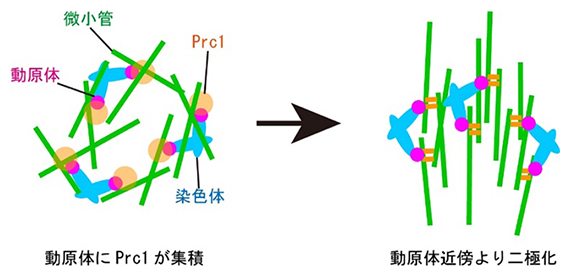
マウス卵母細胞における紡錘体の二極化モデル(二極は上下方向)
背景
卵子のもとになる細胞を卵母細胞といいます。卵子が正確につくられるためには、減数分裂の際に卵母細胞で二つの極を持つ「紡錘体」が形成され、それぞれの極に向かって正しい数の染色体が分配される必要があります。染色体分配に失敗すると、卵子の染色体数異常が引き起こされ、流産や先天性疾患の原因になります。特にヒトの卵母細胞では、染色体分配の失敗が高い頻度で起こります。
紡錘体は微小管[5]からなり、染色体を紡錘体の二つの極に向かって引っ張るため、紡錘体は二極性である必要があります。多くの動物の体細胞分裂では、中心体が「土台」となって紡錘体は二極化されますが、哺乳類などの卵母細胞にはこの土台となる中心体が存在しません。そのため、卵母細胞は体細胞とは異なる機構によって紡錘体を二極化していると考えられますが、その機構はよく分かっていませんでした。
また、同じ哺乳類でも、マウスの卵母細胞は二極性の紡錘体を正確に形成できるのに対し、ヒトの卵母細胞は紡錘体の二極化に失敗しやすく、これが染色体分配異常の主要な原因の一つとなっています。しかし、なぜヒト卵母細胞で紡錘体形成の失敗が多いのかは、明らかになっていませんでした。
研究手法と成果
国際共同研究グループは、細胞分裂時に染色体のくびれ部分に形成される「動原体」の機能に着目し、動原体を構成するタンパク質の一つ「Ndc80」を卵母細胞で欠失させるコンディショナルノックアウトマウス[7]を作製しました。そして、このマウスから得られた卵母細胞の紡錘体形成の様子を高解像度ライブイメージング[8]で観察し、解析しました。その結果、Ndc80を欠失させた卵母細胞は、減数第一分裂の際に紡錘体の二極化に失敗し、染色体がさまざまな方向に散らばってしまうことが明らかになりました(図1)。
体細胞分裂では、動原体を構成するNdc80は微小管と結合することが知られています。しかし、卵母細胞におけるNdc80の機能を詳しく解析したところ、紡錘体の二極化のために、Ndc80は微小管と結合する必要はないものの、動原体に局在しなければならないことが分かりました。これらは、卵母細胞の動原体は、減数第一分裂における紡錘体の二極化に必須であることを示しています。
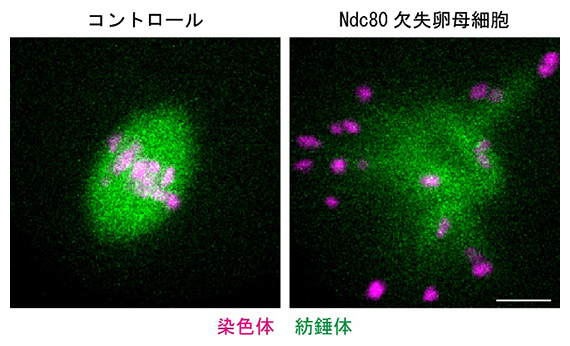
図1 Ndc80タンパク質を欠失させたマウス卵母細胞における紡錘体
マウス卵母細胞の減数第一分裂中期のライブイメージング。紡錘体の観察は微小管結合タンパク質と緑色蛍光タンパク質の融合により、染色体の観察はヒストンと赤色蛍光タンパク質により、それぞれ可視化した。右のように、Ndc80を欠失した卵母細胞は、減数第一分裂時に紡錘体の二極化に失敗し、染色体が散らばってしまった。スケールバーは10マイクロメートル(μm、1μmは1,000分の1mm)。
次に、紡錘体の二極化に関わるNdc80の機能をさらに詳しく知るため、Ndc80と相互作用する因子の探索を行いました。その結果、微小管の制御因子として知られるタンパク質「Prc1」を同定しました。これまで中心体を持つ体細胞では、Prc1は紡錘体形成に必要とされないことは分かっていましたが、卵母細胞での機能は明らかになっていませんでした。そこで、マウス卵母細胞でのPrc1の観察や、Prc1のノックダウン[9]実験を行ったところ、Prc1はNdc80を介して動原体とその近傍の微小管に局在し、紡錘体の二極化に寄与することを見いだしました(図2)。
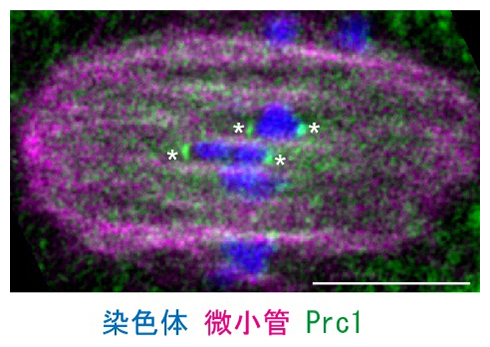
図2 マウスの卵母細胞紡錘体におけるPrc1タンパク質の局在
マウス卵母細胞の減数第一分裂後期の蛍光染色像。Prc1は、動原体(*)とその近傍の微小管に局在する。スケールバーは10μm。
興味深いことに、このNdc80を介してPrc1を動原体に集積させる機構は、減数第二分裂における紡錘体の二極化には必須ではありませんでした。この理由の一つは、Prc1の発現量の違いにあり、減数第二分裂ではPrc1の発現量が高く、細胞全体で高濃度になっており、動原体によって局所的にPrc1を集積させる機構がなくても紡錘体が二極化できるからです。
Ndc80欠失卵母細胞にPrc1を人為的に高発現させたところ、減数第一分裂における紡錘体の二極化は回復したものの、染色体分配の失敗が高頻度で起きた(図3)ことから、動原体を使わない減数第二分裂における紡錘体の二極化機構は、減数第一分裂ではうまく働かないことが示されました。
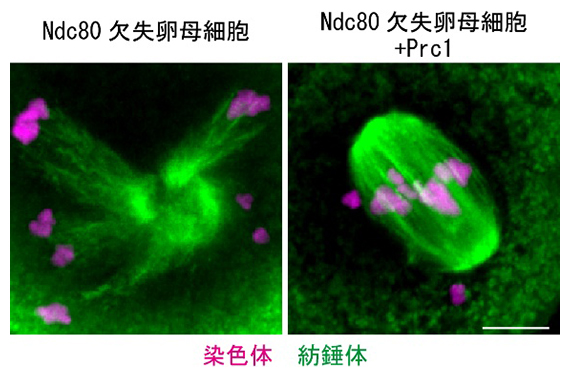
図3 Prc1の増加によるマウス卵母細胞における二極性紡錘体形成の回復
右のように、Ndc80を欠失させたマウス卵母細胞にPrc1を高発現させたところ、二極性の紡錘体形成が回復した。しかし、正しい位置に並ばない染色体も出現し、染色体分配の失敗が高頻度で起きた。スケールバーは10μm。
これらの結果から、マウス卵母細胞の減数第一分裂では、動原体を「土台」としてPrc1を集積させることで、染色体を分配する装置である紡錘体を二極化しており、また、このような機構は卵母細胞の減数第一分裂でのみ必要とされることが明らかになりました(図4)。
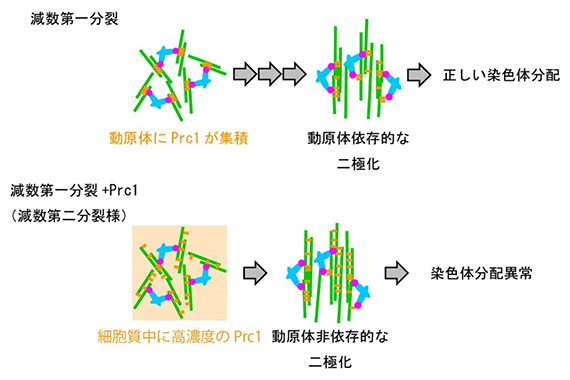
図4 マウス卵母細胞における動原体が主導する紡錘体の二極化機構
(上)紡錘体微小管(緑)、動原体(赤)、Prc1(黄)、染色体(青)の関係を表した模式図。正常な減数第一分裂では、細胞内に少量存在するPrc1がNdc80の働きにより動原体に集積し、紡錘体の二極化(上下方向)が起きる。
(下)Prc1を増加させ、減数第二分裂と同様に細胞質内に大量のPrc1が存在する状況を人為的に再現すると、動原体非依存的な紡錘体形成が生じ、染色体分配異常を引き起こす。
このような重要な機構がヒトの卵母細胞でも働いているかを調べるため、研究用に提供を受けたヒト卵母細胞を用いてPrc1の局在を調べました。その結果、Prc1の動原体局在は観察されなかったことから、マウスと異なり、ヒトではこの機構が働かないことが分かりました。
今後の期待
本研究から、マウスの卵母細胞において、染色体を分配する装置である紡錘体の二極化には、動原体が土台として働く機構が必須であることが明らかになりました。一方、紡錘体の二極化に失敗しやすいことが知られているヒト卵母細胞では、マウスのようなPrc1の動原体への局在が観察されませんでした。このような差異は、ヒト卵母細胞で紡錘体の二極化が失敗しやすいことに対する説明の一つといえます。
紡錘体の二極化の失敗は、卵子の染色体数異常の主要な原因の一つです。今後、さらにマウス卵母細胞とヒト卵母細胞における紡錘体形成機構の相違を明らかにしていくことで、卵子の染色体数異常の原因の理解につながると期待できます。
補足説明
1.卵母細胞、卵子
卵原細胞が増加した後、分化してできた雌性生殖細胞を卵母細胞と呼ぶ。卵母細胞は大きく成長した後、減数分裂を経て受精可能な卵子となる。
2.紡錘体
細胞分裂の際に染色体を分配するための細胞内構造で、主に微小管から構成される。
3.動原体、Ndc80
動原体は染色体のくびれ部分上に形成されるタンパク質複合体で、Ndc80はその構成タンパク質の一つ。染色体分配の際に、微小管が染色体を動かすための牽引部位となる。体細胞分裂では姉妹染色分体のそれぞれに動原体が一つずつ形成され、減数第一分裂では相同染色体のそれぞれに動原体が一つずつ形成される。
4.減数分裂
真核生物の生殖器官(精巣や卵巣)にある生殖細胞で見られる、配偶子(精子や卵子)を作るための特別な様式の細胞分裂。途中でDNAが複製されることなく、2回の細胞分裂(減数第一分裂、減数第二分裂)が起こる。染色体セットの数が半分に減少して配偶子にもたらされるために、減数分裂と呼ぶ。
5.中心体、微小管
「微小管」は細胞内で繊維状の構造をとる細胞骨格の一つである。α/βチューブリンの重合体で、重合・脱重合を可逆的に行うことで形態を変化させる。チューブリン重合の核となる構造を「微小管形成中心」と呼び、多くの動物の体細胞分裂では、主に「中心体」がその役割を果たす。
6.Prc1
Prc1は逆方向性微小管の架橋タンパク質で、体細胞分裂では染色体分配後の細胞質分裂に必要である。
7.コンディショナルノックアウトマウス
特定の細胞や時期特異的に、標的遺伝子をノックアウトすることができるマウス。
8.ライブイメージング
生きた細胞や組織、個体の生命活動を継時観察すること。特に、GFPなどの蛍光タンパク質を用いて特定のタンパク質や細胞を標識し、蛍光顕微鏡でその動きや変化を詳細に観察する手法は、生命科学の必須の手法となっている。
9.ノックダウン
mRNAの分解や翻訳抑制などの操作により、遺伝子機能の発現を大幅に低下させること。本研究では、RNA干渉(RNAi)と呼ばれる手法を卵母細胞に適用した。
国際共同研究グループ
理化学研究所 生命機能科学研究センター
染色体分配研究チーム
上級研究員 吉田 周平(よしだ しゅうへい)
客員研究員 橋本 周(はしもと しゅう)
(大阪市立大学大学院医学研究科特任准教授、IVFなんばクリニック研究部長)
大学院生リサーチ・アソシエイト 西山 翠(にしやま すい)
訪問研究員 三品 達平(みしな たっぺい)
研究員(研究当時)オレリアン・クートワ(Aurelien Courtois)
研究員 京極 博久(きょうごく ひろひさ)
チームリーダー 北島 智也(きたじま ともや)
生体モデル開発チーム
技師 阿部 高也(あべ たかや)
テクニカルスタッフⅡ 白石 亜紀(しらいし あき)
ニューカッスル大学 Newcastle Fertility Centre
研究員 リサ・リスター(Lisa Lister)
婦人科学コンサルタント チャウダリー・ミーナクシ(Choudhary Meenakshi)
教授 メアリー・ハーバート(Mary Herbert)
IVFなんばクリニック
院長 中岡 義晴(なかおか よしはる)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究(A)「卵母細胞に特有な動原体の役割(研究代表者:北島智也)」、同新学術領域研究(研究領域提案型)「配偶子インテグリティの構築(領域代表者:林克彦)」などによる支援を受けて行われました。
原論文情報
Shuhei Yoshida, Sui Nishiyama, Lisa Lister, Shu Hashimoto, Tappei Mishina, Aurélien Courtois, Hirohisa Kyogoku, Takaya Abe, Aki Shiraishi, Meenakshi Choudhary, Yoshiharu Nakaoka, Mary Herbert and Tomoya S. Kitajima, “Prc1-rich kinetochores are required for error-free acentrosomal spindle bipolarization during meiosis I in mouse oocytes”, Nature Communications, 10.1038/s41467-020-16488-y
発表者
理化学研究所
生命機能科学研究センター 染色体分配研究チーム
チームリーダー 北島 智也(きたじま ともや)
上級研究員 吉田 周平(よしだ しゅうへい)
客員研究員 橋本 周(はしもと しゅう)
(大阪市立大学大学院医学研究科特任准教授、IVFなんばクリニック研究部長)
IVFなんばクリニック
院長 中岡 義晴(なかおか よしはる)
報道担当
理化学研究所 広報室 報道担当
大阪市立大学 広報課
IVFなんばクリニック 本部
尾本 優里子(おもと ゆりこ)