2024-11-20 理化学研究所,京都大学iPS細胞研究財団,株式会社カネカ
理化学研究所(理研)バイオリソース研究センター iPS細胞高次特性解析開発チームの林 洋平 チームリーダー、髙﨑 真美 開発研究員、公益財団法人京都大学iPS細胞研究財団 研究開発センター、株式会社カネカ 再生・細胞医療研究所らの共同研究グループは、iPS細胞[1]の樹立から、大量培養までを浮遊培養で一貫して行うことに成功しました。
本研究成果は、iPS細胞を用いた再生医療において、産業向けの大量製造法の確立や患者由来iPS細胞の直接的な自家医療の開発に貢献すると期待できます。
従来の接着培養条件下で培養したヒトiPS細胞に比べ、浮遊培養条件下ではヒトiPS細胞が突発的に分化しやすいという課題がありました。しかし、共同研究グループは、2種類の化合物を加えることで、突発的分化が抑制されることを見いだしました。さらに、これらの化合物を添加した浮遊培養条件で、(1)ヒト末梢血単核球からのiPS細胞の樹立、(2)単一細胞を選別してクローン株を拡大、(3)自己複製特性を維持しながらの長期培養、(4)浮遊培養からの直接凍結保存とその直接解凍からの浮遊培養開始、(5)臨床グレードのヒトiPS細胞株の効率的な大量培養、といった、一連の培養プロセスを成功させました。この結果は、ヒトiPS細胞の状態を正確に制御しながら浮遊培養できたことで、安定的かつ自動化された臨床応用への道が開かれることを示しています。
本研究は、科学雑誌『eLife』オンライン版(11月12日付)に掲載されました。
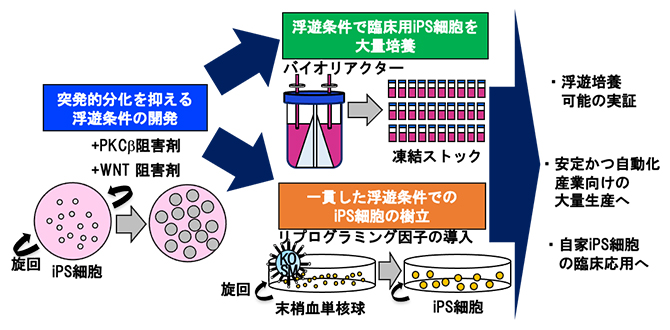
本研究の概要
背景
ヒトiPS細胞による細胞治療を可能にするためには、大量の細胞が必要です。そのため大規模な製造システムの開発が不可欠です。一般的に、ヒトiPS細胞は培養皿などの底面に接着させて培養します。しかし、大量培養を実現しようとすれば、必要な培養皿の表面積が大きくなります。そのため、培養皿を積層化させたり、マイクロキャリア[2]といった特殊な素材上に接着させたりする方法も使われています。しかし、培養処理が煩雑になったり、コストが高くなったりするなどの難点があります。そのため、ヒトiPS細胞に対しては、特殊な材料を用いない浮遊培養法を開発することで、再生医療の産業化に向けて、費用対効果の大きい大量生産が可能となり、自動化や安全性確保の上でもメリットがあると考えられます。
これまでもヒトiPS細胞の迅速かつ大規模な生産を可能にする浮遊培養技術の開発がいくつか試みられてきました。これらの研究において、ヒトiPS細胞の長期培養や大量培養が達成されています。しかし、これまでの研究では、培養細胞の遺伝子発現に基づいた精密な制御や検証が行われているわけではありません。また、ヒトiPS細胞の樹立、単一細胞を選別(ソーティング)してのクローン株の拡大培養、浮遊培養からの直接凍結保存と浮遊培養への直接解凍播種(はしゅ)、といったヒトiPS細胞の培養において重要な一連のプロセスは浮遊培養条件では確立されていませんでした。
研究手法と成果
まず、既存の培養液を用いて、ヒトiPS細胞を通常の接着培養条件と浮遊培養条件(非接着性の細胞培養プレート内で90回転/分の連続旋回)でそれぞれ10日間培養し、遺伝子・タンパク質発現を比較解析しました。その結果、神経や皮膚のもととなる外胚葉、筋肉や腎臓のもととなる中胚葉、肺や胃腸のもととなる内胚葉のいずれのマーカー遺伝子・タンパク質においても、その発現が浮遊培養条件で上昇していました(図1)。この結果は、浮遊培養条件では、ヒトiPS細胞が突発的にさまざまな方向へ分化してしまうことを示しています。
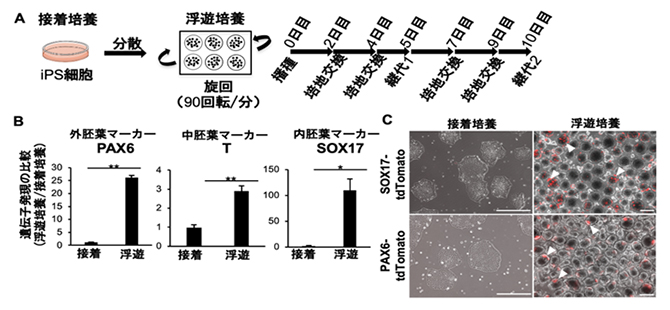
図1 iPS細胞の接着培養または浮遊培養条件における突発的分化の比較
(A)iPS細胞の浮遊条件での培養方法。通常の接着培養条件で培養したiPS細胞コロニーを単一細胞へ分散後、既存の培養液を用いて非接着性の培養プレート内で連続旋回(90回転/分)しながら10日間(5日目に1度継代)培養し、遺伝子・タンパク質発現を解析した。
(B)浮遊培養したiPS細胞では、外胚葉、中胚葉、内胚葉それぞれで発現するマーカー遺伝子であるPAX6、T、SOX17の発現が、接着条件に比較して有意に上昇していた。
(C)浮遊培養したiPS細胞では、タンパク質PAX6、SOX17の発現が検出された。典型的なタンパク発現箇所を白色の矢印で示す。スケールバーは400μm。
そこで、この突発的分化を抑えるための解決策を模索しました。既知の生物学的知見から、外胚葉、中胚葉、内胚葉それぞれの分化に関与する生物学的シグナル経路[3]が分かっていたので、それらに対する阻害剤の中から突発的分化を抑える効果を持つものを探しました。その結果、外胚葉分化を抑制するPKC(β)シグナル[4]阻害剤、中・内胚葉分化を抑制するWNTシグナル[5]阻害剤を見いだし、これらを培地に加えることで浮遊条件のヒトiPS細胞を長期的に安定して未分化状態のまま培養できました(図2)。
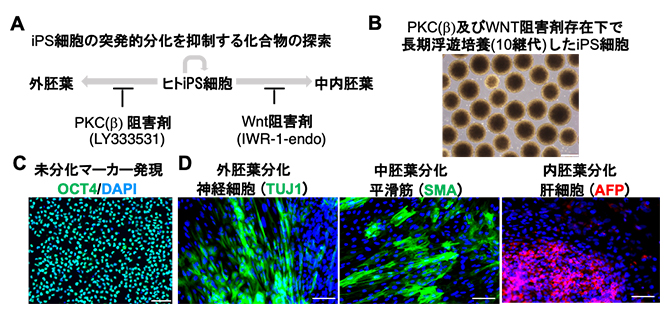
図2 シグナル阻害剤存在下で長期に浮遊培養したiPS細胞の未分化性と多能性の評価
(A)浮遊培養におけるiPS細胞の突発的分化を抑制する化合物をスクリーニングし、PKC(β)シグナル阻害剤(LY333531)により外胚葉への分化が、WNTシグナル阻害剤(IWR-1-endo)により中・内胚葉への分化が、それぞれ抑制されることを明らかにした。
(B)PKC(β)およびWNTシグナル阻害剤存在下で長期浮遊培養(10継代)したiPS細胞の位相差顕微鏡像。表面が滑らかで均一な細胞塊を形成しており、突発的な細胞分化が少ない。スケールバーは400μm。
(C)PKC(β)およびWNTシグナル阻害剤存在下で長期浮遊培養したiPS細胞においても、未分化マーカーOCT4のタンパク質レベルでの発現が維持されていた。スケールバーは100μm。
(D)長期浮遊培養したiPS細胞の多能性を、ランダムに分化させる胚葉体形成法にて評価した。外胚葉分化として神経マーカーのTUJ1、中胚葉分化として平滑筋マーカーのSMA、内胚葉分化として肝細胞マーカーのAFPを指標とし、それぞれ免疫染色法で解析した。その結果、3胚葉への分化能を維持していることが示された。スケールバーは100μm。
この条件を用いて、臨床用iPS細胞株に対して、バイオリアクター[6]での大量培養を行いました。3~4日間隔で3回、新しい培地に細胞を分注して継代を行い、1回当たり約100万個の細胞が入った凍結チューブを300本程度作製する大量培養を達成しました。その後、各回の凍結チューブの一部を解凍播種し、大量培養されたiPS細胞の特性評価を実施しました。その結果、大量生産されたiPS細胞は、通常の接着培養条件と遜色なく自己複製、多能性、核型(染色体構成)が維持され、ドーパミン作動性神経前駆細胞、心筋細胞、肝細胞といった再生医療や創薬にとって有用な細胞種への分化誘導効率も変わりないことが示されました(図3)。以上の結果は、二つの阻害剤を用いた浮遊培養法が再生医療用iPS細胞の大量生産に適していることを示しています。
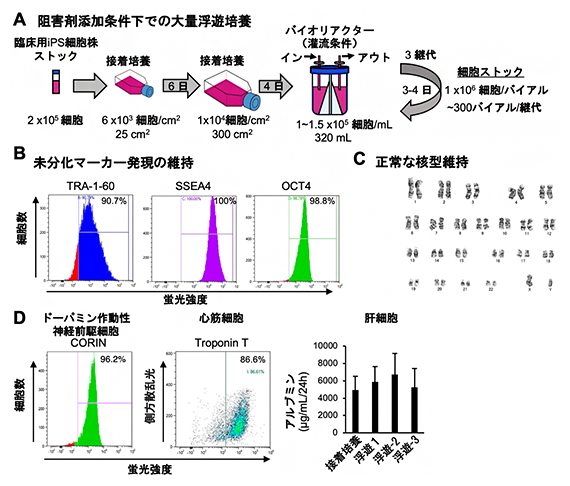
図3 臨床用iPS細胞の阻害剤存在下での大量浮遊培養とストック作製
(A)バイオリアクターを用いた阻害剤添加条件下での臨床用iPS細胞の大量浮遊培養とストック作製の模式図。
(B)浮遊培養によって大量生産されたiPS細胞の未分化マーカー(TRA-1-60、SSEA4、OCT4)の発現を1細胞ごとに解析した。それぞれの未分化マーカーを発現している細胞は同程度の蛍光強度を示す。TRA-1-60、SSEA4、OCT4の発現が高く維持されている。
(C)浮遊培養によって大量生産されたiPS細胞の核型解析。正常な核型が保たれている。
(D)浮遊培養によって大量生産されたiPS細胞の多能性の検証。ドーパミン作動性神経前駆細胞、心筋細胞、肝細胞といった、再生医療に有用な細胞種への高い分化誘導効率が示された。
さらに、共同研究グループは、WNTとPKC(β)それぞれのシグナル阻害剤を添加した浮遊培養条件で、FACS[7]を用いて単一の細胞を選別し、そこから増殖したクローン株を取得できることを示しました。また、この浮遊培養条件から直接凍結ストック用の細胞を取り出し、さらに凍結ストックを直接浮遊培養条件に移して解凍播種することにも成功しています。このように、この浮遊培養条件では、細胞培養のプロセスとして重要なクローン株の取得、凍結ストックの採取、解凍播種を問題なく行うことができ、作業上の負担も少ないことが示されました。
ヒトiPS細胞の臨床利用のためには、閉鎖系で確実かつ効率的にヒトiPS細胞を樹立することが望まれています。これを達成するために、今回開発した浮遊培養条件下でヒトiPS細胞を樹立することを試みました。ヒト末梢血単核球[8]を材料として、センダイウイルスベクター[9]の感染、あるいはエピソーマルベクター[10]による遺伝子導入によってヒトiPS細胞を作製しました(図4A)。これらの遺伝子導入法は、細胞のゲノムに遺伝子が挿入されないため、臨床応用に向けたiPS細胞の作製に使われています。遺伝子導入した細胞を、5~6日ごとに継代を繰り返して浮遊培養を続けました。さらに、浮遊培養したヒトiPS細胞をFACSによって単一細胞に選別し、これらの単一細胞由来のクローンを懸濁(けんだく)培養条件下で増殖させ、クローン株を作製しました。このクローン株の細胞凝集体は均一な球状構造を示し、突発的な細胞分化はほとんど見られませんでした(図4B)。また、クローン株は正常な核型を維持しており、自己複製マーカー陽性であり(図4C)、さまざまな細胞へと分化できる多能性を示すことが分かりました(図4D)。これらの結果は、PKC(β)とWNTのシグナル阻害剤を添加した浮遊培養条件で、正常なヒトiPS細胞株の樹立に成功したことを示しています。
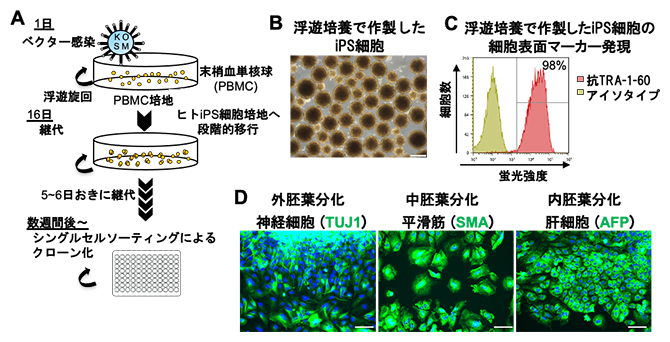
図4 一貫した浮遊培養条件でのiPS細胞の樹立
(A)一貫した浮遊培養条件でのiPS細胞樹立の概要図。
(B)浮遊培養によって作製されたiPS細胞の位相差顕微鏡像。スケールバーは400μm。
(C)浮遊培養によって作製されたiPS細胞での未分化マーカーTRA-1-60の発現を1細胞ごとに解析した。98%の細胞が陽性であることを示している。
(D)浮遊培養によって作製されたiPS細胞の多能性をランダムに分化させる胚葉体法で確認した。外胚葉分化として神経細胞マーカーのTUJ1、中胚葉分化として平滑筋マーカーのSMA、内胚葉分化として肝細胞マーカーのAFPを指標とし、それぞれ免疫染色法で解析した。スケールバーは100μm。
今後の期待
本研究では、浮遊培養条件下でヒトiPS細胞を樹立し、大量生産するための一連の方法を開発しました。この方法は、マイクロキャリアや透析バッグなどの特別な材料を必要とせず、既存のさまざまな培地や多くのヒトiPS細胞株で有効です。細胞の状態を精密に制御しながら、大量培養、自動化、安全性確保を行う点で有利だと考えられ、従来の方法では達成できなかった新規の産業応用が期待されます。
今回の研究では、突発的な細胞分化を抑える因子として、PKC(β)阻害剤とWNTシグナル阻害剤という二つの化合物を同定しました。これらの阻害剤がどのような分子機構でヒトiPS細胞の突発的分化を抑えるかを今後調べていくことで、より精密化された分化誘導法の開発にもつながると考えられます。
さらに、培養液に上記の化合物を添加することにより、浮遊培養条件下で初めて末梢血単核球からヒトiPS細胞を作製することにも成功しました。浮遊培養は、無菌的な閉鎖系での自動培養などにつなげやすいため、自家ヒトiPS細胞からの自家細胞治療の実現に貢献できると期待されます。
補足説明
1.iPS細胞
ヒトを含む哺乳類の体細胞に、初期化する能力を持つ因子を導入し、培養すると、その細胞はさまざまな組織や臓器の細胞に分化する能力を持つ多能性幹細胞に変化する。この細胞をiPS細胞(誘導性多能性幹細胞)と呼ぶ。iPSはinduced pluripotent stemの略。
2.マイクロキャリア
再生医療やバイオ医薬品の製造の細胞培養の工程において、細胞の足場材として用いる微小担体。培養液中でその表面に細胞を接着させることで3次元浮遊培養を可能にする素材。これにより、従来のシャーレを用いた2次元的な培養と比較して、培養スペースの狭小化と効率的な大量細胞培養が可能になる。
3.生物学的シグナル経路
細胞外の特定の分子による情報によって細胞の状態が変化する過程。具体的には、成長因子やホルモンなどの細胞外メッセンジャー分子を細胞表面、または細胞内の受容体が受け取り、続くセカンドメッセンジャーやタンパクキナーゼによるタンパク質リン酸化の過程を経て、特定のシグナル経路が細胞内に伝達される。伝達された情報は、遺伝子の発現上昇や抑制といった細胞応答に変換され、細胞の増殖や分化が制御される。
4.PKC(β)シグナル
PKC(プロテインキナーゼC)は、多様な細胞内シグナル伝達経路に関与する広範な標的タンパク質をリン酸化する。PKC酵素は多くのアイソザイムで構成されるが、これらのうちPKC(β)は、リン脂質ジアシルグリセロール(DG)と細胞内カルシウイオンの濃度上昇によって活性化すると考えられ、標的のタンパク質のリン酸化を介して、細胞内にシグナルを伝達する。
5.WNTシグナル
生物学的シグナル経路の一つ。糖タンパク質であるWNTが、細胞表面受容体のFRIZZLEDを介して、細胞内にシグナルを伝達する。古典的WNT経路、非古典的WNT経路である平面内細胞極性(PCP)経路、WNT/カルシウム経路に分類される。WNTシグナルは、初期発生における体軸パターン形成、細胞運命の決定、細胞増殖、細胞遊走などの制御に関与する。また、WNTシグナルは多能性幹細胞から中胚葉や内胚葉の前駆細胞への分化を誘導することが知られている。
6.バイオリアクター
動植物の細胞や微生物、酵素などを用いて物質の合成や分解、生産を行う生化学反応装置。再生医療分野においては、容器内の温度、pH、攪拌速度、流量、通気などを管理しながら、ヒト由来細胞の大量培養に用いられ、無菌性の確保、自動化、低コスト化に貢献すると考えられている。
7.FACS
不均一な細胞懸濁液を細胞が一列に流れる状態にし、それにレーザー光を照射して反射する光を測定することで、細胞一つ一つの情報を読み取り、さらにその情報を基に細胞を分取する(ソーティング)方法。抗体が特定のタンパク質を認識して結合する原理を利用し、細胞表面マーカーに対する蛍光標識した特異性の高い抗体を用いて、標識された目的の細胞を選別できる。FACSはFluorescence-activated cell sortingの略。
8.ヒト末梢血単核球(PBMC)
血液細胞のうち、リンパ球、単球、樹状細胞などを合わせた、単核白血球の総称である。技術的には、全血サンプルから遠心分離によって濃縮することができる。PBMCはPeripheral Blood Mononuclear Cellsの略。
9.センダイウイルスベクター
細胞内への遺伝子導入のために用いられる、センダイウイルスを改変して作られたベクター(運び屋)である。センダイウイルスベクターは、分裂、非分裂細胞にかかわらず遺伝子導入可能なRNAウイルスベクターで、宿主のゲノムDNAには取り込まれず、細胞質内で数週間ほど発現が持続する。
10.エピソーマルプラスミドベクター
遺伝子導入した細胞のゲノムDNAに取り込まれなくても、持続的に遺伝子発現を維持できるようにした非ウイルス性のプラスミドベクター。技術的には、EBウイルス(エプスタイン・バール・ウイルス)由来のDNA複製を維持するためのEBNA1タンパク質をコードする遺伝子と、そこから発現されたEBNA1タンパク質が結合でき、ベクターのDNA複製起点となるOri配列を同一ベクター内に構築してある。
共同研究グループ
理化学研究所 バイオリソース研究センター
iPS細胞高次特性解析開発チーム
チームリーダー 林 洋平(ハヤシ・ヨウヘイ)
(筑波大学 医学医療系 教授[連携大学院]、筑波大学グローバル教育院 ライフイノベーション学位プログラム 教授[協働大学院])
開発研究員 髙﨑 真美(タカサキ・マミ)
基礎科学特別研究員 伊藤 秀矩(イトウ・ヒデノリ)
テクニカルスタッフⅡ(研究当時)若林 玲実(ワカバヤシ・タマミ)
研修生 清水 智哉(シミズ・トモヤ)
(東京理科大学 大学院薬学研究科学科 博士課程、日本学術振興会特別研究員DC1)
テクニカルスタッフⅡ(研究当時)安 瑜利(アン・ユリ)
テクニカルスタッフⅡ(研究当時)辺見 康子(ヘンミ・ヤスコ)
細胞材料開発室
室長 中村 幸夫(ナカムラ・ユキオ)
上級技師 野口 道也(ノグチ・ミチヤ)
遺伝子材料開発室
研究員(研究当時)中出 浩司(ナカデ・コウジ)
公益財団法人京都大学iPS細胞研究財団
業務執行理事/研究開発センター長 塚原 正義(ツカハラ・マサヨシ)
主幹研究員 梅景 雅史(ウメカゲ・マサフミ)
主任研究員 加藤 智朗(カトウ・トモアキ)
株式会社カネカ 再生・細胞医療研究所
執行役員・研究所長 上田 恭義(ウエダ・ヤスヨシ)
基幹研究員 中石 智之(ナカイシ・トモユキ)
主任 西下 直希(ニシシタ・ナオキ)
主任(研究当時)伊吹 将人(イブキ・マサト)
主任(研究当時)河井 義和(カワイ・ヨシカズ)
研究員 河嶋 照(カワシマ・テラス)
研究員 政安 梨緒(マサヤス・リオ)
研究員 鈴木 麻菜美(スズキ・マナミ)
研究員(研究当時)竹内 和博(タケウチ・カズヒロ)
研究員(研究当時)神林 昌(カンバヤシ・ショウ)
研究支援
本研究は、日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療実現加速化プログラム疾患特異的iPS細胞を用いた病態解明・創薬研究課題「疾患特異的iPS細胞の樹立・特性解析・加工の高度化・効率化・情報公開(研究代表者:林洋平、課題番号:JP23bm1423010)」、同再生医療実現拠点ネットワークプログラム「再生医療用iPS細胞ストック開発拠点(研究代表者:山中伸弥、課題番号:JP15bm0104001)」による助成、株式会社カネカとの共同研究費、公益財団法人京都大学iPS細胞研究財団寄付金を受けて行われました。
本研究には理研バイオリソース研究センターから提供されたバイオリソース(ヒトiPS細胞HPS0063、HPS0077、HPS1006、HPS0381)が使用されました。
原論文情報
Mami Matsuo-Takasaki, Sho Kambayashi, Yasuko Hemmi, Tamami Wakabayashi, Tomoya Shimizu, Yuri An, Hidenori Ito, Kazuhiro Takeuchi, Masato Ibuki, Terasu Kawashima, Rio Masayasu, Manami Suzuki, Yoshikazu Kawai, Masafumi Umekage, Tomoaki M Kato, Michiya Noguchi, Koji Nakade, Yukio Nakamura, Tomoyuki Nakaishi, Naoki Nishishita, Masayoshi Tsukahara, Yohei Hayashi., “Complete suspension culture of human induced pluripotent stem cells supplemented with suppressors of spontaneous differentiation”, eLife, 10.7554/eLife.89724
発表者
理化学研究所
バイオリソース研究センター iPS細胞高次特性解析開発チーム
チームリーダー 林 洋平(ハヤシ・ヨウヘイ)
開発研究員 髙﨑 真美(タカサキ・マミ)
公益財団法人京都大学iPS細胞研究財団 研究開発センター
株式会社カネカ 再生・細胞医療研究所
報道担当
理化学研究所 広報室 報道担当
公益財団法人京都大学iPS細胞研究財団 企画部門 広報グループ
株式会社カネカ IR・広報(Investors & Public Relations)部