副作用の少ない創薬への展開に期待
2020-09-14 東京大学,愛媛大学,名古屋工業大学,日本医療研究開発機構
発表者
降旗大岳(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士後期課程2年生)
山中聡士(愛媛大学 プロテオサイエンスセンター 特定研究員)
本田敏章(名古屋工業大学大学院工学研究科 生命・応用化学専攻 博士前期課程2年生)
宮内裕美子(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任研究員)
浅野敦子(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任研究員:研究当時)
柴田哲男(名古屋工業大学大学院工学研究科 共同ナノメディシン科学専攻 教授)
田之倉優(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任教授)
澤崎達也(愛媛大学 プロテオサイエンスセンター 教授)
宮川拓也(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任准教授)
発表のポイント
- 免疫調節薬として多発性骨髄腫などの治療に利用されているサリドマイドは、体内での代謝を経て催奇形性(有害な副作用)を引き起こします。
- サリドマイドの水酸化代謝物が催奇形性の原因となるSALL4タンパク質に作用する仕組みを明らかにしました。
- 本研究の成果は、サリドマイドの薬理作用の理解を深めるもので、副作用の少ない薬剤開発への応用が期待できます。
発表概要
サリドマイドとその誘導体は、免疫調節薬として多発性骨髄腫などの治療に有効ですが、催奇形性などの避けられない副作用のために厳しい規制のもとで使用されています。これら薬剤の副作用を減らして薬効を高めるには、それらが私たちの体内で作用する仕組みを理解することが不可欠です。
東京大学大学院農学生命科学研究科の宮川拓也特任准教授と田之倉優特任教授、愛媛大学プロテオサイエンスセンターの澤崎達也教授を中心とした研究グループは、サリドマイドと体内でつくられる水酸化代謝物が催奇形性の原因となるSALL4タンパク質に作用する仕組みを明らかにしました。サリドマイドはSALL4タンパク質への作用に加え、免疫調節に関わるIKZF1タンパク質にも作用しますが、その水酸化代謝物ではIKZF1への作用が大きく低下していました。これはSALL4とIKZF1の構造の違いに起因しており、サリドマイドの標的タンパク質への作用が体内代謝を経て変化する仕組みを初めて説明することができました。これは、水酸化代謝物の生成と作用の仕組みに基づいて、有害な副作用を低減し望ましい薬効を高める創薬につながる成果です。
発表内容
サリドマイドは、1950年代に睡眠導入剤として使用された薬剤ですが、服用した妊婦から生まれた胎児に重度な催奇形性(注1)を示し、大きな薬害問題を引き起こしました。その後、サリドマイドに免疫調節作用などの有用な薬理活性が認められ、サリドマイドとその誘導体(レナリドミド及びポマリドミド)は厳格な安全管理のもと、現在最も有効な免疫調節薬(immunomodulatory imide drugs, IMiDs)として多発性骨髄腫などの治療に使用されています。これまでに、サリドマイドが作用する複数の標的タンパク質が探索され、サリドマイドの薬理作用の分子メカニズムが少しずつ解き明かされてきました。C2H2 ZF型転写因子(注2)のIKZF1とSALL4はサリドマイドの免疫調節作用と催奇形性にそれぞれ関与しています。これらの転写因子は、ZF2ドメイン(注3)と呼ばれる領域でCRBNタンパク質(注4)に結合すると、分解されて細胞から取り除かれます。そしてこの現象はサリドマイドによって引き起こされます(図1)。一方、体内のシトクロムP450(注5)という酵素のはたらきにより、投与されたサリドマイドは水酸化された代謝物(5-hydroxythalidomide, 5HT)を生じます。最近、この5HTがサリドマイドよりも効率的にSALL4の分解のみを引き起こすことが発見され(図1)、SALL4の分解に起因するサリドマイドの催奇形性のメカニズムにおいて、5HTの作用が重要視されていました。
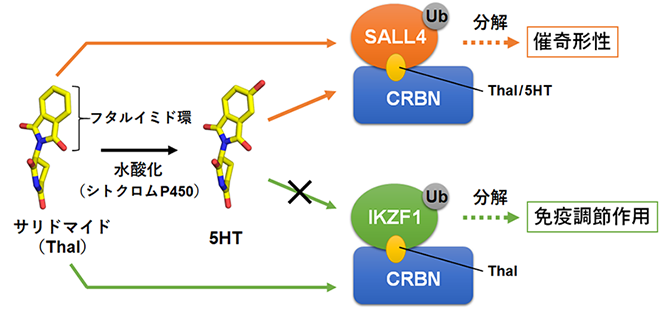
今回研究グループは、C2H2 ZF型転写因子に対するサリドマイドの作用が体内での代謝によって変化し、SALL4の分解が選択的に促進される仕組みを明らかにすることに成功しました。まず本研究では、サリドマイドまたは5HTの存在下でSALL4とCRBNの複合体を形成させ、それらの構造をX線結晶構造解析法(注6)により決定しました。その結果、どちらの化合物もCRBNにSALL4のZF2ドメインをつなぎとめる役割を果たしていることが明らかになりました(図2)。また、5HTはその水酸基でCRBNと強く結合しており、これがSALL4の分解を5HTが促進する主要因であることがわかりました。次に5HTがIKZF1に作用できない理由を検討したところ、ZF2ドメインを構成するβヘアピン上の2番目と9番目のアミノ酸残基(P2及びP9)が5HTの水酸基の近くに位置していることがわかり、これらの種類がSALL4とIKZF1で異なることが見出されました(図2)。実際にSALL4とIKZF1の間でアミノ酸残基を入れ替えると5HTはSALL4ではなくIKZF1に作用できるようになり、特にP2がC2H2 ZF型転写因子に対する5HTの選択性の鍵となる構造であることが明らかになりました。
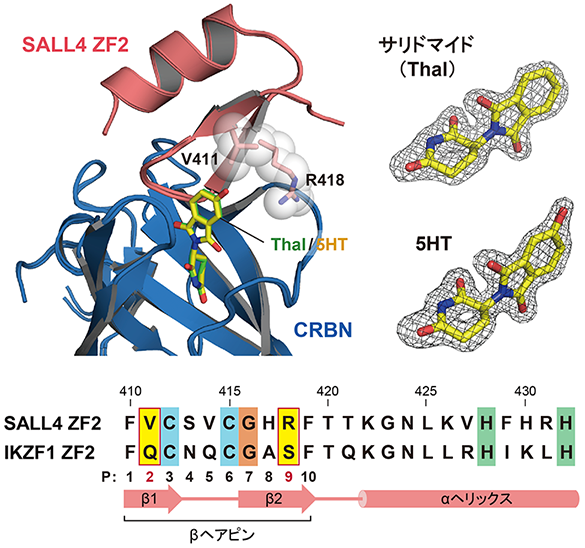
以上の研究成果により、サリドマイドの標的タンパク質に対する作用が体内代謝を経て変化する仕組みを初めて説明することができました。また本研究で見出したサリドマイドの水酸化を回避できれば、SALL4の分解に起因する催奇形性を低減可能な新たな薬剤設計が期待できます。さらに本研究の知見は、サリドマイドを含むIMiDsの薬効に必要な標的タンパク質への作用効率を高めるために、C2H2 ZF型転写因子に見られる構造の違いを利用できる可能性を示しています。
本研究は、東京大学大学院農学生命科学研究科、愛媛大学プロテオサイエンスセンター、名古屋工業大学大学院工学研究科との共同研究としておこなわれました。また、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)「コムギ無細胞系による構造解析に適した複合体タンパク質生産・調製技術と低分子抗体作製技術の創出」(課題番号JP20am0101077)、「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(PFにおけるタンパク質立体構造解析の支援と高度化、相関構造解析への展開)」(課題番号JP19am0101071、支援番号2290)、日本学術振興会(JSPS)「科学研究費助成事業」(課題番号JP16H06579、JP17J08477、JP17H06112、JP19H03218)、武田科学振興財団の支援を受けておこなわれました。
発表雑誌
- 雑誌名
- 「Nature Communications」(2020年9月14日付)
- 論文タイトル
- Structural bases of IMiD selectivity that emerges by 5-hydroxythalidomide(サリドマイドの水酸化により発現するIMiD選択性の構造基盤)
- 著者
- Hirotake Furihata, Satoshi Yamanaka, Toshiaki Honda, Yumiko Miyauchi, Atsuko Asano, Norio Shibata, Masaru Tanokura, Tatsuya Sawasaki, Takuya Miyakawa
- DOI番号
- 10.1038/s41467-020-18488-4
用語解説
- (注1)催奇形性
- 薬剤などのある種の物質が生物の正常な発生を阻害して奇形を生じさせる性質や作用のことです。
- (注2)C2H2 ZF(Cys2-His2 zinc finger)型転写因子
- C2H2 ZFは2つのシステイン残基(Cys、C)と2つのヒスチジン残基(His、H)の配列モチーフをもつタンパク質またはドメインです。この配列モチーフで亜鉛イオン(Zn2+)を結合し、2本のβストランドと1本のαヘリックスが折り畳まった構造を形成します。C2H2 ZFの中にはDNA結合ドメインとして機能するものがあり、ここではC2H2 ZFをドメインとしてもつ転写因子をC2H2 ZF型転写因子と総称しています。
- (注3)ZF2ドメイン
- IKZF1とSALL4は分子内に複数のC2H2 ZFをドメインとしてもち、このうち配列上で2番目に位置するC2H2 ZFをZF2ドメインと呼びます。
- (注4)CRBNタンパク質
- CRBNは生体内におけるサリドマイドの受容体タンパク質で、サリドマイドを介して結合した標的タンパク質にユビキチンを標識するE3ユビキチンリガーゼの構成因子として機能します。
- (注5)シトクロムP450
- 多様な酸化反応を触媒する一群の酵素で、薬物などの生体外物質の代謝においては脂溶性物質の水溶性を高める第I相反応で機能します。
- (注6)X線結晶構造解析法
- 低分子化合物やタンパク質、それらが複数結合した複合体を適した溶液組成や温度などの条件下で徐々に析出させていくと、分子が規則正しく並んだ結晶を形成します。X線結晶構造解析法は、この結晶にX線を照射して得られるX線回折像を解析することで、分子の三次元構造を決定する方法です。本研究では、高エネルギー加速器研究機構(KEK)フォトンファクトリー(PF)のタンパク質結晶学ビームラインを利用して高分解能のX線回折像を収集しました。
お問い合わせ先
研究内容について
東京大学大学院農学生命科学研究科 応用生命化学専攻
養生訓を科学する医食農連携寄付講座
特任准教授 宮川拓也(みやかわたくや)
愛媛大学プロテオサイエンスセンター
無細胞生命科学部門
教授 澤崎達也(さわさきたつや)
名古屋工業大学大学院工学研究科 共同ナノメディシン科学専攻
教授 柴田哲男(しばたのりお)
東京大学大学院農学生命科学研究科・農学部
農学系事務部 総務課総務チーム
総務・広報情報担当(広報情報担当)
愛媛大学研究支援部 研究支援課
研究拠点第三チーム
名古屋工業大学 企画広報課
AMED事業について
日本医療研究開発機構(AMED)創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)