細胞内カルシウム恒常性維持機構の破綻が引き起こす疾病の原因解明に光
2020-09-14 東北大学,東京大学,京都産業大学,日本医療研究開発機構
発表のポイント
- クライオ電子顕微鏡による構造解析により、細胞中のカルシウムの恒常性維持に重要な小胞体膜局在カルシウムポンプSERCA2bの高分解能構造を世界で初めて明らかにした。
- SERCA2bに特徴的なC末端テール領域による、構造・活性制御機構を世界で初めて明らかにし、小胞体カルシウムポンプの新しい活性制御機構モデルを提唱した。
概要
細胞小器官の一つである小胞体は、カルシウムを取り込むことで細胞内カルシウムイオン濃度を適切に維持しています。SERCA2bはこのカルシウムの取り込みを担い、全組織に広く発現している膜タンパク質です。東北大学多元物質科学研究所の張玉霞博士課程学生、渡部聡助教、稲葉謙次教授(生命科学研究科、理学研究科化学専攻兼担)、および東京大学医学研究科の包明久助教、吉川雅英教授、京都産業大学の永田和宏名誉教授(現JT生命誌研究館館長)らを中心とした共同研究グループは、筋収縮の制御、神経伝達、アポトーシスの誘導、タンパク質の品質管理など、様々な生命現象において重要な役割をもつ細胞内カルシウムイオンの恒常性を保つ上で必須のカルシウムポンプSERCA2bの高分解能構造を、クライオ電子顕微鏡単粒子解析注1)という技術を用いて、世界で初めて明らかにしました。
本研究成果は、2020年8月12日14時(アメリカ東部時間)に米国科学誌Science Advancesに掲載されました。
研究の背景
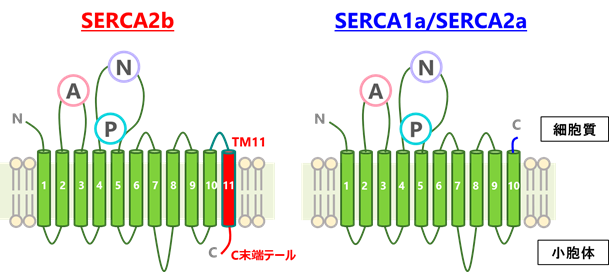
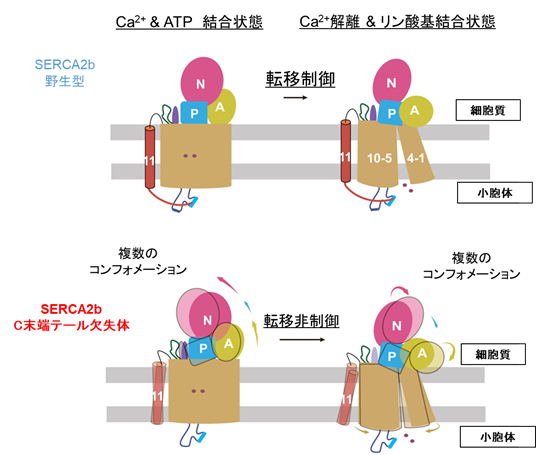
小胞体は膜タンパク質や分泌タンパク質の生合成やカルシウムの貯蔵を行う細胞内小器官です。小胞体膜局在のATP駆動型カルシウムポンプであるSERCA2bは、細胞質から小胞体内へカルシウムを取り込むことで、カルシウムの制御や細胞内のカルシウム濃度の恒常性維持において重要な役割をもつことが知られています。ハウスキーピングタンパク質注2)であるSERCA2bは、組織特異的に発現するアイソフォーム注3)のSERCA1aやSERCA2aとは異なり、C末端に11番目の膜貫通へリックス(TM11)と約10アミノ酸からなるテール領域(C末端テール)が存在します(図1)。TM11とC末端テールからなるC末端領域によってSERCA2bの活性やカルシウムに対する結合能が制御されることは報告されていましたが、その詳しい機構については分かっていませんでした。
SERCA2bのアイソフォームであるSERCA1aについては、様々な中間状態で構造が決定されていますが、SERCA2bの構造については、我々が昨年報告した一つの中間状態の結晶構造のみでした。そこで、全組織において細胞内のカルシウムイオン恒常性維持に関わるSERCA2bの活性制御メカニズムを原子レベルで理解するため、SERCA2bの複数の中間状態の構造を決定することを試みました。
研究の内容と成果
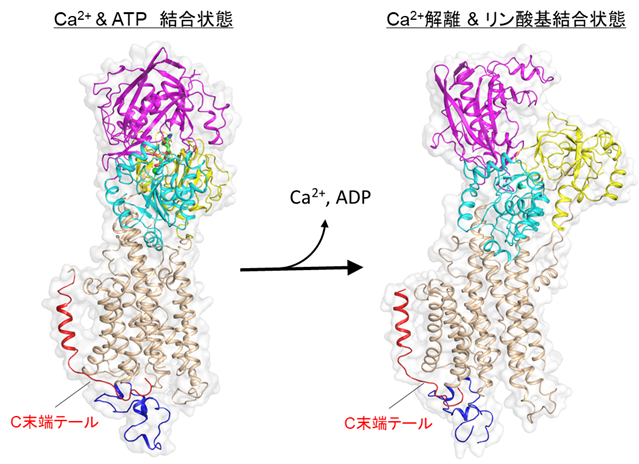
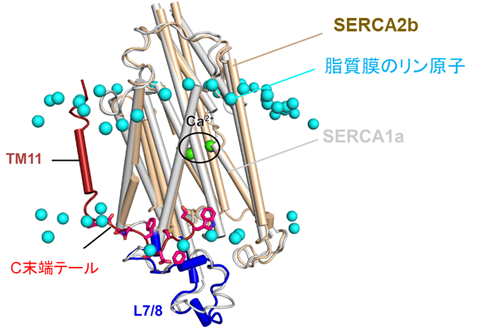
本研究ではまず、SERCA2bの高分解能構造をクライオ電子顕微鏡単粒子解析法により決定するために、十分に精製されたSERCA2bの試料を調製しました。その試料を用いて電子顕微鏡測定のためのグリッドを作製し、東京大学医学研究科に設置されているハイエンドクライオ電子顕微鏡装置Titan Krios(ThemoFisher製)を用いて、データ収集を行いました。その結果、カルシウムイオンとATP分子が結合している状態については2.9Å分解能で、ATPが加水分解しリン酸基のみが結合している状態については2.8Å分解能でそれぞれ構造決定しました。得られた構造から、SERCA2bはAドメイン(駆動ドメイン)、Nドメイン(ATP結合ドメイン)、Pドメイン(リン酸化ドメイン)の三つの細胞質ドメインと、11個の膜貫通ヘリックス(N末端からTM1~TM11と呼ぶ)、そしてC末端テールからなることを確認しました(図2)。SERCA2bに特徴的なC末端テールは、従来の研究で予想されていた位置とは大きく異なり、C末端テールは、TM11から膜と液面の境界領域に沿って水平方向に伸び、SERCA2b分子内でL7/8ループの一部と相互作用することが分かりました(図3)。さらに、C末端テールを欠失させた変異体についても、クライオ電子顕微鏡による高分解能構造解析を行ったところ、SERCA2bは三つの細胞質ドメインの位置が異なる複数のコンフォメーションをとることも分かりました。この結果から、C末端テールによってSERCA2bの全体構造は制御され、この構造制御によってSERCA2bのカルシウム輸送活性が制御されていることが示唆されました(図4)。以上の結果は、細胞のカルシウム恒常性維持機構を分子構造レベルで理解する大きな一助となると解釈できます。
今後の展開
本研究成果として、SERCA2bの反応サイクルにおいてカルシウムとATPが結合した状態、およびカルシウムが解離しかつATPの加水分解が起こった後の状態について、これまでで最も高分解能の構造解析に世界で初めて成功しました。その結果、C末端テールを介した活性制御メカニズムを提唱することができました。クライオ電子顕微鏡は、試料を結晶化する必要がないため、溶液状態の構造をおよそ正確に反映していると解釈できます。
今後は、他の複数の中間状態でのSERCA2bの構造解析をクライオ電子顕微鏡により行うことで、反応サイクル全体におけるSERCA2bのC末端領域を介した活性制御機構の全容を解明したいと考えています。小胞体内でのカルシウムイオンが枯渇すると、小胞体内でのタンパク質品質管理がうまくいかなくなり、小胞体ストレスを誘導することが知られています。またそのことが神経変性疾患、糖尿病などの疾患を引き起こすことも報告されています。さらに、SERCA2bの遺伝子変異による機能不全が、ダリエ病注4)という皮膚病を引き起こすことも広く知られています。したがって、本研究で得られた知見は、細胞内カルシウムが関わる種々の生命現象の解明のみならず、細胞のカルシウム恒常性維持機構の破綻が引き起こす様々な疾病の原因解明および治療戦略の開発につながることが期待されます。
本研究への支援
本成果は、以下の事業・研究領域・研究課題によって得られました。
- 科学技術振興機構(JST)戦略的創造研究推進事業 チーム型研究(CREST)
-
- 研究領域:
- 「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中啓二 東京都医学総合研究所 理事長兼所長)
- 研究課題名:
- 「小胞体恒常性維持機構:Redox, Ca2+, タンパク質品質管理のクロストーク」
- 研究代表者:
- 永田和宏(京都産業大学タンパク質動態研究所 所長 兼 生命科学部 教授)
- 研究期間:
- 2013年10月~2019年3月
JSTは本領域で、先端的ライフサイエンス領域と構造生物学との融合により、ライフサイエンスの革新に繋がる「構造生命科学」と先端基盤技術の創出を目指します。上記研究課題では、ERdj5を中心として、タンパク質恒常性(ホメオスタシス)・レドックス(酸化還元)恒常性・カルシウム恒常性の3つの主要な恒常性のクロストーク分子基盤を、静的(X線結晶構造解析注5))および動的(FRET解析)な構造解析によって解明します。
- 日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)
-
- 研究課題名:
- クライオ電顕による細胞内ネイティブ複合体構造解析
- 研究代表者:
- 吉川雅英(東京大学 医学系研究科 教授)
用語解説
- 注1)クライオ電子顕微鏡単粒子解析
- タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、極低温で電子顕微鏡像を観測する。個々の分子像は、様々な向きで氷薄膜に包埋された分子の投影像であり、投影方向毎に分類した分子像の平均像を組み合わせることで高分解能の三次元構造を構築する。
- 注2)ハウスキーピングタンパク質
- 細胞の生存に必須で、組織によらず全ての細胞で発現しているタンパク質の総称。
- 注3)アイソフォーム
- 基本的な機能に関する構造またはアミノ酸配列は同じだが、一部が異なっているタンパク質。異なる遺伝子から発現する。
- 注4)ダリエ病
- 角質が正常に作られなくなり、かさぶたのついた褐色の丘疹が皮膚にたくさんできる皮膚病の一つ。小胞体へカルシウムイオンを輸送するカルシウムポンプSERCA2bがうまく機能しなくなることで細胞内のカルシウム濃度の異常が起こり、細胞間結合と表皮細胞分化に異常をきたすことが原因とされる。
- 注5)X線結晶構造解析
- 分子の構造を高分解能で決定する手法の1つ。分子が規則正しく並んだ結晶に強いX線を照射すると回折という現象が起こり、回折データを解析することで、結晶を構成する分子の構造を原子レベルで決定することができる。
発表論文
- 著者
- Zhang. Y., Inoue, M., Tsutsumi, A., Watanabe, S., Nishizawa, T., Nagata, K., Kikkawa, M. and Inaba, K.*
- タイトル
- Cryo-EM structures of SERCA2b reveal the mechanism of regulation by the luminal extension tail
- 雑誌名
- Science Advances
- DOI
- 10.1126/sciadv.abb0147
お問い合わせ先
研究に関すること
東北大学 多元物質科学研究所 教授
稲葉謙次(いなばけんじ)
報道担当に関すること
東北大学 多元物質科学研究所 広報情報室
伊藤智恵(いとうともえ)
京都産業大学 広報部
増村尚人(ますむらなおと)
東京大学 医学部・医学系研究科 総務チーム(総務担当)
AMEDの事業に関すること
創薬等ライフサイエンス研究支援基盤事業(BINDS)担当
日本医療研究開発機構 創薬事業部 医薬品研究開発課