2021-12-21 東京大学,九州大学,大阪市立大学,科学技術振興機構,日本医療研究開発機構
発表者
平井 誠也(東京大学大学院理学系研究科生物科学専攻 博士後期課程1年)
富松 航佑(九州大学生体防御医学研究所 助教)
立花 太郎(大阪市立大学大学院工学研究科化学生物系専攻 教授)
大川 恭行(九州大学生体防御医学研究所 教授)
胡桃坂 仁志(東京大学定量生命科学研究所 クロマチン構造機能研究分野 教授)
発表のポイント
- マウス(Mus musculus)の新規ヒストン(注1)H3mm18を含むヌクレオソーム(注2)構造をクライオ電子顕微鏡解析(注3)により世界で初めて解明しました。
- H3mm18が不安定で弛緩したヌクレオソームを形成すること、そしてH3mm18の発現が筋分化に重要な遺伝子の発現を制御することを明らかにしました。
- 筋肉の発達と再生のメカニズムを理解するための重要な情報を提供し、創薬や再生医療への応用が期待されます。
発表概要
東京大学大学院理学系研究科生物科学専攻の平井誠也大学院生、東京大学定量生命科学研究所クロマチン構造機能研究分野の胡桃坂仁志教授らのグループは、大阪市立大学大学院工学研究科化学生物系専攻の立花太郎教授、九州大学生体防御医学研究所の富松航佑助教、大川恭行教授らのグループとの共同研究で、マウスのヒストンH3mm18による新規のDNA折りたたみの基盤構造を解明し、H3mm18が筋分化を制御することを世界で初めて明らかにしました。
真核生物のゲノムDNAは、タンパク質と結合し、折りたたまれて細胞核内に収納されています。このDNAの折りたたみ構造は、細胞の分化にともなって様々な形に変化し、遺伝子の発現を制御しています。DNA折りたたみの基本単位は、ヌクレオソームと呼ばれる構造体で、ヒストンと呼ばれるタンパク質に、DNAが巻きついた円盤状の構造を形成しています。本研究では、はじめに、これまで機能が不明であった新規ヒストン亜種(注4)H3mm18を含むヌクレオソームを試験管内で再構成し、クライオ電子顕微鏡解析と生化学的解析を組み合わせることにより、ヌクレオソームの詳細な立体構造と性状を解明しました。その結果、H3mm18が通常のヌクレオソームに比べ、DNA末端の運動性が高く、不安定なヌクレオソームを形成するという性質を見出しました。さらに、骨格筋細胞内の遺伝子発現を解析することで、H3mm18が筋分化に重要な遺伝子制御を担っていることを突き止めました。
本研究で明らかになった構造情報は、筋肉の発達異常に対する化合物を探索する上での基盤となり、創薬や再生医療への発展が期待されます。
本研究は、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(研究総括:胡桃坂仁志、JPMJER1901)、JST戦略的創造研究推進事業(CREST)「細胞ポテンシャル測定システムの開発」(研究代表:大川恭行、JPMJCR16G1)、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代表:胡桃坂仁志、JP20am0101076)、及び日本学術振興会(JSPS)の科学研究費助成事業 新学術領域研究(研究領域提案型)「ヌクレオソーム高次構造とダイナミクスの解析によるクロマチン潜在能の解明」(代表:胡桃坂仁志、JP18H05534)、新学術領域研究(研究領域提案型)「細胞核・クロマチン構造のダイナミクスと遺伝子制御」(代表:大川恭行、JP18H05527)の支援を受けて実施されました。また、クライオ電子顕微鏡解析は、AMED BINDS(代表:吉川雅英、JP19am0101115)からの支援を受けて実施されました。
発表内容
研究の背景
真核生物のゲノムDNAは、ヒストンタンパク質と結合し、折りたたまれて染色体を形成することで細胞核内にコンパクトに収納されています(図1)。このDNAの折りたたみ構造の基本単位は、ヌクレオソームと呼ばれる円盤状の構造体で、4種のヒストンタンパク質H2A、H2B、H3、H4各二分子ずつからなる複合体にDNAが約1.7回巻きつくことで形成されています。ヒストンには様々な亜種が存在し、それらが特殊なヌクレオソーム構造を形成することで、DNAの折りたたみを変化させ、遺伝子発現を制御することが分かっています。
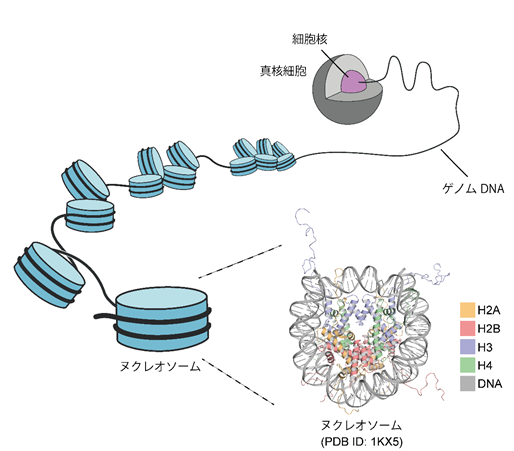
図1 細胞核内におけるDNAの折りたたみとヌクレオソーム真核細胞の遺伝子発現は、DNAの折りたたみ構造によって制御されています。DNAの折りたたみの基本構造であるヌクレオソームは、4種類のヒストンタンパク質H2A、H2B、H3、H4各二分子ずつからなる複合体にDNAが約1.7回巻きついた円盤状の構造をしています。
2015年に、九州大学の大川教授らのグループは新規のヒストン亜種14種類を発見し、世界的な注目を集めていました。それらの中でも、ヒストンH3の新規亜種H3mm18は、骨格筋において組織特異的な発現が確認されており、他のヒストンに比べ、ゲノムDNAから解離しやすい性質をもつことが分かっていました。このことからH3mm18は、これまでに報告されている主要型ヒストンとは大きく異なる、特徴的なDNAの折りたたみ構造を形成することで、筋分化へ関与すると考えられていました。しかし、その機能は明らかになっておらず、どのようなヌクレオソームを形成するのか、その構造、性質の解明が期待されていました。
研究内容
研究グループは、新規ヒストン亜種H3mm18を含むヌクレオソームの立体構造を世界で初めて解明し、H3mm18ヌクレオソームが通常のヌクレオソームとは大きく異なった特徴を持つことを明らかにしました。さらに、H3mm18が筋分化に重要な遺伝子発現を制御することを解明しました。
本研究では、マウスのヒストンH3mm18、H2A、H2B、H4を精製し、試験管の中でDNAと反応させることでヌクレオソームを再構成しました。この再構成ヌクレオソームを、クライオ電子顕微鏡によって観察し、H3mm18ヌクレオソームの詳細な立体構造の決定に成功しました(図2)。今回明らかとなった立体構造から、通常型のヌクレオソームと比べて、H3mm18ヌクレオソームではDNA末端領域がフレキシブルに運動していることが明らかになりました。また、ヌクレオソームの構造安定性を調べるために、H3mm18ヌクレオソームの熱に対する安定性を試験しました。その結果、H3mm18が極めて不安定なヌクレオソームを形成することが分かりました。これらのことから、H3mm18がヌクレオソームの構造と性質を大きく変化させることで、ゲノムDNAの折りたたみ構造を変化させることが考えられます。
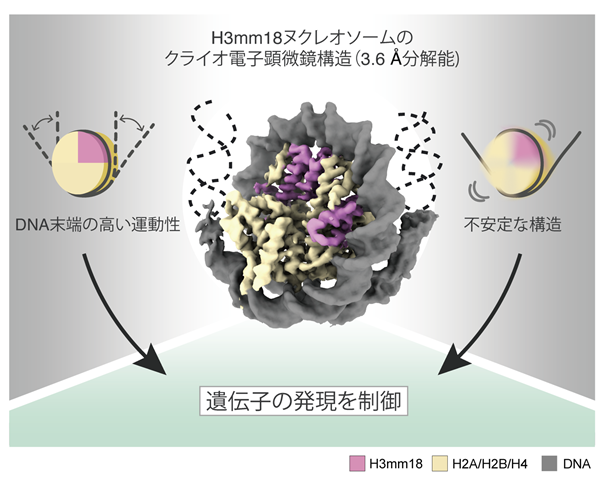
図2 H3mm18ヌクレオソームのクライオ電子顕微鏡構造H3mm18を含むヌクレオソームの構造をクライオ電子顕微鏡解析により明らかにしました。通常のヌクレオソームと同様に、H3mm18を含むヒストン八量体にDNAが巻きついた構造をとっていることがわかりました。しかし、波線で示したDNA末端領域の構造が定まらないことから、DNA末端がフレキシブルに運動していることが示唆されました。生化学的解析から、H3mm18ヌクレオソームはDNA末端がヒストンから剥がれやすく運動性が高いという性質、ヌクレオソーム構造が不安定で崩壊しやすいという性質を持つことが明らかとなりました。このようなH3mm18ヌクレオソームの性質はゲノムDNAの折りたたみ構造を大きく変化させると考えられます。結果として、骨格筋の分化に重要な遺伝子の発現が制御されていることを示しました。
この折りたたみ構造の変化が与える遺伝子発現の制御は、細胞を用いた実験で調べました。H3mm18はマウス骨格筋組織の細胞に特異的な発現が確認されているため、骨格筋分化の遺伝子制御に関与することが考えられていました。そこでH3mm18を発現させたマウスの筋芽細胞を用いて骨格筋への分化誘導を行ったところ、MyHCやMyogなどの骨格筋形成に必要な遺伝子発現の減少と共に、筋芽細胞の骨格筋分化が抑制されました。
これらのことから、H3mm18がDNAの折りたたみ構造を変化させることで、筋肉の発達において重要な遺伝子を制御していることが示唆されました。これまでに解析されたヒストン亜種は、ゲノムDNAに安定に結合するものが主流で、H3mm18ヌクレオソームの不安定性は、これまでのヒストンH3亜種の中でも突出しています。本研究は、このような新規の性質を持つヒストン亜種の機能解明に踏み込んだものであり、ヒトやマウスを含む真核生物の染色体の機能を理解する上で重要な知見を与えました。
今後の展開
本研究で明らかになったH3mm18ヌクレオソームの構造情報や性質、遺伝子発現制御の知見は、筋肉の発達や再生のメカニズムを理解する上で重要です。本研究により得られた、ヒストンH3mm18によるDNA折りたたみの基盤情報をもとに研究が進むことで、筋分化におけるH3mm18の機能制御を目的とした創薬や、再生医療への発展が期待されます。
発表雑誌
- 雑誌名
- 『Nucleic Acids Research』(オンライン版:2021年12月21日)
- 論文タイトル
- Unusual nucleosome formation and transcriptome influence by the histone H3mm18 variant
- 著者
- Seiya Hirai, Kosuke Tomimatsu, Atsuko Miyawaki-Kuwakado, Yoshimasa Takizawa, Tetsuro Komatsu, Taro Tachibana, Yutaro Fukushima, Yasuko Takeda, Lumi Negishi, Tomoya Kujirai, Masako Koyama, Yasuyuki Ohkawa, and Hitoshi Kurumizaka
- DOI番号
- 10.1093/nar/gkab1137
- URL
- https://doi.org/10.1093/nar/gkab1137
用語解説
- (注1)ヒストン
- ヌクレオソーム(注2)を構成する塩基性タンパク質。H2A、H2B、H3、H4の4種類が存在し、各二分子ずつ含むヒストン複合体にDNAが巻きつくことでヌクレオソームを形成する(図1)。
- (注2)ヌクレオソーム
- 4種類のヒストン(注1)タンパク質からなる複合体にDNAが約1.7回巻きついた円盤状の構造体。真核生物のゲノムDNAの折りたたみ構造を決める基本単位(図1)。
- (注3)クライオ電子顕微鏡
- 急速凍結した試料に電子線照射することで、溶液中に近い状態の生体高分子の構造を観察できる装置。2017年に開発者である3人の研究者が、ノーベル化学賞を受賞したことでも知られ、近年の技術革新により高分解能で生体高分子の構造解析ができるようになった。
- (注4)ヒストン亜種
- 主要型のヒストンとは一部のアミノ酸が異なるタンパク質。主要型ヒストンがゲノムDNAの複製期に多く発現し、新たに合成されたゲノムDNAに取り込まれる一方、ヒストン亜種はDNA複製期非依存的に発現するものが多く、主要型ヒストンに変わってヌクレオソームを形成することで、ゲノムDNAの折りたたみを調節し、遺伝子発現を制御する。
お問い合わせ先
本研究に関するお問い合わせ
国立大学法人東京大学 定量生命科学研究所
教授 胡桃坂 仁志(クルミザカ ヒトシ)
報道担当
国立大学法人東京大学定量生命科学研究所 総務チーム
国立大学法人九州大学 広報室
公立大学法人大阪大阪市立大学 広報課
国立研究開発法人科学技術振興機構 広報課
JST事業に関するお問い合わせ
国立研究開発法人科学技術振興機構 研究プロジェクト推進部
内田 信裕(ウチダ ノブヒロ)
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 創薬等ライフサイエンス研究支援基盤事業(BINDS)