2023-12-01 理化学研究所,京都大学アイセムス
理化学研究所(理研)脳神経科学研究センター 細胞機能探索技術研究チームおよび光量子工学研究センター 生命光学技術研究チームの宮脇 敦史 チームリーダー、安藤 亮子 研究員、細胞機能探索技術研究チームの下薗 哲 研究員、京都大学アイセムス(高等研究院 物質-細胞統合システム拠点)の藤原 敬宏 特定准教授らの共同研究グループは、蛍光タンパク質StayGoldを改良し、生細胞における分子や生体膜の動態を、蛍光の褪色(たいしょく)[1]の心配なく観察する技術を確立しました。
本研究成果は、バイオイメージングの広範囲において褪色問題の解消をもたらし、蛍光観察の時空間の幅の飛躍的な拡張と、定量性を求める創薬開発研究に貢献することが期待されます。
宮脇チームリーダーらが2022年に発表したStayGoldは褪色しにくい(光安定性が高い)という利点がありますが、二量体を形成するため、分子や膜を標識する際に人工構造物の生成をもたらす危険性があります。今回、共同研究グループは、StayGoldの結晶構造を決定し、その情報を基に単量体変異体mStayGoldを開発しました。また、StayGoldの直列連結体tdStayGoldの分散性[2]を高めた改良版を開発しました。これらを利用することで、ゴルジ体膜やミトコンドリア内膜、アクチン線維や微小管などの細胞骨格、細胞分裂の際に見られる染色体凝縮タンパク質などの高精細、高速、長時間の観察に成功しました。
本研究は、科学雑誌『Nature Methods』オンライン版(11⽉30⽇付︓⽇本時間12⽉1⽇)に掲載されました。
背景
クラゲやサンゴ、イソギンチャクの体内で野生型の蛍光タンパク質はほとんどが二量体や四量体の多量体で存在しています。海中で光を発するために、極めて安定な多量体を形成することで熱や光などの環境ストレスに対する耐性を得ていると考えられています。
一方、研究者が蛍光タンパク質を蛍光標識として使うときには、多量体はあまり芳しくありません。遺伝子レポーターとして細胞を標識する、あるいは細胞小器官の内腔を標識する上では問題ありません。しかし標識対象が分子や膜になると、結合した蛍光タンパク質が、多量体を形成するにつれて、分子同士や膜同士を架橋してしまう恐れがあります。そうなると、本来とは異なる構造物を観察することになってしまいます。このため、分子や膜の蛍光標識を可能にする単価の蛍光タンパク質が求められています。
宮脇チームリーダーらが2022年に発表した蛍光タンパク質「StayGold」注1)は、明るくかつ褪色しにくいという利点がありますが、二量体を形成することが欠点として指摘されてきました。本研究ではStayGoldの二量体問題の解決を目指しました。
問題点の解決には、次の2通りのアプローチが考えられます。第一は、StayGoldの結晶構造を解析し、二量体形成関連部位のアミノ酸を置換して単量体StayGold(mStayGold)を作製する解決法です(図1右上)。抜本的なアプローチと言えます。第二は、StayGoldを直列に連結しタンデムダイマー(連結二量体)StayGold(tdStayGold)を作製する解決法です(図1右下)。妥協的なアプローチですが、標識分子のサイズに制限が無ければ、mStayGoldに比べて、対象部位に2倍の蛍光を付与できる利点があります。
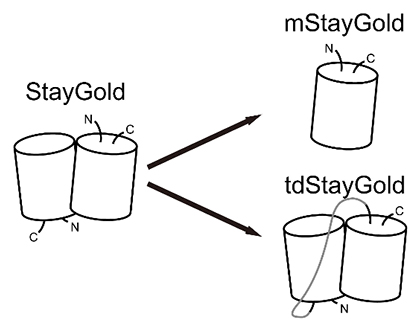
図1 StayGoldの二量体問題を解決するmStayGoldおよびtdStayGold
β環構造(βシートというタンパク質の二次構造から成る環状の構造)を円柱で表している。tdStayGoldにおいてN末端(N)とC末端(C)を連結するペプチドを灰色の線で示している。
tdStayGold作製においてはStayGoldのβ環構造にメスを入れる必要はありません。実際に、StayGoldを直列に連結してtdStayGoldを作製してみたところ、元の高い光安定性と明るさが維持されることが分かり、本研究ではより高い分散性(細胞内で凝集を作りにくい性質)を目指して改良することを考えました。一方、mStayGoldの開発には二量体構造を壊すことが必要です。β環構造にメスを入れつつStayGoldが持つ特長をどの程度維持できるかが課題となりました。
注1)2022年4月26日プレスリリース「色褪せない蛍光タンパク質」
研究手法と成果
共同研究グループはまず、mStayGoldの開発を目指し、StayGoldの結晶構造を1.56オングストローム(Å、1Åは100億分の1メートル)の分解能で決定しました(図2)。この構造情報から、二量体形成に関与するアミノ酸を複数同定しました。ところで、二量体界面に向かって発色団の先端[3]が突き出しており、同定したアミノ酸残基の全てに変異を導入すると、二量体形成を阻止できても光安定性や明るさに影響が現れることが懸念されました。そこで、さまざまな組み合わせで変異を部分的に導入し、明るさと光安定性を保持しながら単量体性を示す変異体を探索しました。最終的に、図2に示した数個のアミノ酸残基に変異を導入した産物が明るさと光安定性の評価基準を満たすことが分かりました。
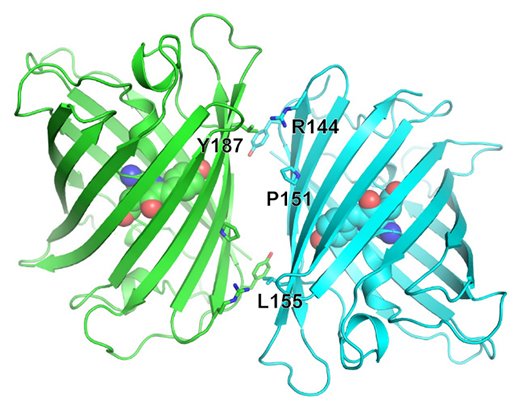
図2 StayGoldの結晶構造
mStayGoldの作製に当たり、二量体形成に関与するアミノ酸の中で変異を導入したものを黒字で示す。β環構造の内部に球で示した発色団の先端は蛍光活性に重要で、この部分が二量体界面の近くに位置することが分かる。
また、tdStayGoldのN末端とC末端を連結するペプチド(図1、右下)の長さと組成を検討することで、細胞内で凝集を作りにくい、高い分散性を示す改良型tdStayGold(td5stayGold、td5oxStayGold、td8ox2StayGold)を作製しました。
続いて、mStayGoldおよび改良型tdStayGoldの褪色のしにくさを評価するため、細胞内のタンパク質(ヒストン)に、それぞれの蛍光タンパク質をつなげました。この細胞に放射照度[4]8.7W/cm2の青色光を連続的に当て、それぞれの蛍光タンパク質の褪色を調べました。比較対照として、元のStayGoldの他に、古典的蛍光タンパク質であるEGFP[5]と、明るい緑色蛍光タンパク質として有名なmGreenLantern[5]、mNeonGreen[5]、mClover3[5]の三つを試しました。それぞれの蛍光タンパク質の絶対的明るさ[6]を考慮して標準化したところ、今回作製した変異体がいずれもStayGoldとほぼ同じ光安定性を持つことが分かりました(図3)。また、一分子追跡観察[7]で使われる照明と同程度の100~1,000W/cm2まで照明強度を上げていくと、StayGoldおよびtdStayGoldは光安定性が弱まるのに対して、mStayGoldは高い光安定性を維持することが明らかになりました。
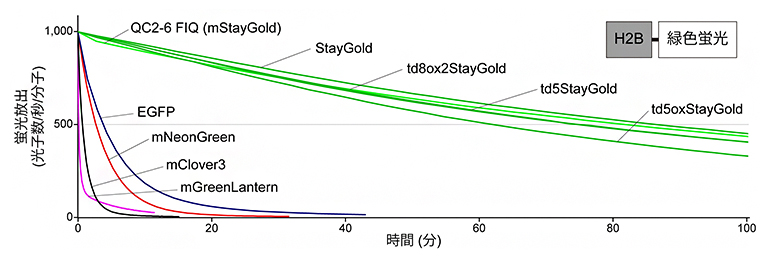
図3 StayGoldとその変異体の褪色曲線
StayGoldおよびその変異体と、比較対照として用いたEGFP、mNeonGreen、mClover3、mGreenLanternの生細胞(HeLa細胞)における光安定性。各蛍光タンパク質はヒストン(H2B)につなげて核に局在させ、wide-field蛍光顕微鏡を使い青色の波長で連続的に光照射(放射照度は8.7W/cm2)した。グラフの縦軸は、蛍光分子1個が1秒間に放出する光子の数。mStayGoldおよび改良型tdStayGoldがStayGoldと同程度に高い光安定性が示すのが分かる。
蛍光タンパク質の明るさを表す指標として、絶対的明るさの他に実用的明るさがあります。これは細胞に発現させた際の蛍光強度で評価されるもので、絶対的明るさに蛍光活性を獲得する速さや細胞内での安定性などが加味された指標です。これを定量的に比較するため、それぞれの蛍光タンパク質を細胞内で発現させ、培養装置内で蛍光タイムラプス観察[8]ができる装置を使って、遺伝子導入後の蛍光強度を調べました。複数区画に区切られた培養プレート上で異なる蛍光タンパク質を一度に比較したところ、StayGoldに比べてmStayGoldがわずかながら早く光ることが示されました(図4)。
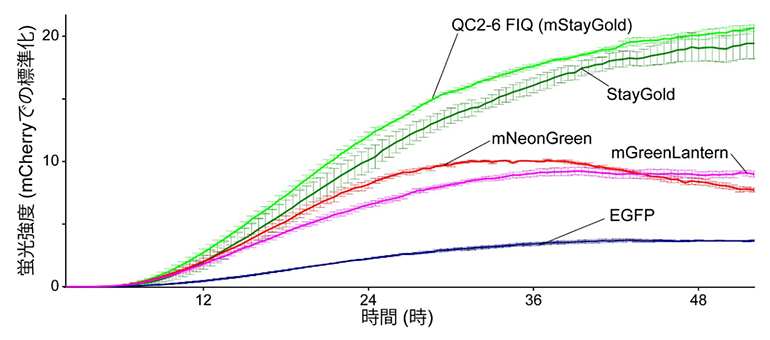
図4 遺伝子発現における蛍光強度変化
mStayGold、StayGold、EGFP、mNeonGreen、mGreenLanternを発現するHeLa細胞の緑色蛍光強度変化を同一プレート上の五つの区画を使って観察した。緑色蛍光タンパク質を導入したのと同じプラスミドDNAから赤色蛍光タンパク質mCherryを発現させ、その赤色蛍光強度で標準化した値(3回の実験の平均±標準誤差)を示す。
こうして、mStayGoldが、単価的な標識を可能にするだけでなく、StayGoldに比べて超高輝度照明に対して光安定性が高く、実用的に明るいことが明らかとなりました。そこで実際にmStayGoldを使って生体分子や生体膜を標識してみました。まずミトコンドリアの膜タンパク質であるシトクロムcオキシダーゼのサブユニットにmStayGoldを融合することで、ミトコンドリア内膜を蛍光標識しました。構造化照明顕微鏡(SIM)[9]という超解像光学顕微鏡を使って、ミトコンドリアのクリステというひだ状の微細構造の動態を、高速かつ持続的に(数分間)観察することに成功しました(図5)。この観察によって、例えば、ミトコンドリアおよびクリステの動きが一過性のカルシウム濃度上昇によって硬直することを初めて捉えることができました。また、mStayGoldでアクチン線維を蛍光標識し、スピニングディスク型共焦点顕微鏡[10]を使って、アクチン線維の動態への薬物による影響を詳細に観察することにも成功しました。
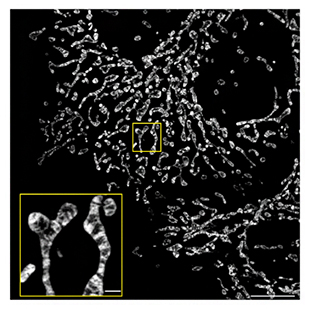
図5 mStayGoldで標識したミトコンドリア内膜
ミトコンドリア内膜をmStayGoldで標識したヒト培養細胞の高精細蛍光画像(スケールバーは10μm、黄色の枠内は1μm)。
tdStayGoldはmStayGoldに比べて理論上1分子の標識当たり2倍の蛍光量を与えることができます。共同研究グループは、ゲノム編集技術[11]を利用し、染色体凝縮タンパク質コンデンシンⅠと改良型tdStayGoldの融合タンパク質が発現する細胞を作製しました。1分子当たりの蛍光量が大きいtdStayGoldは、コンデンシンⅠ本来の少ない発現量を反映する状況でも十分な蛍光シグナルを得るために適当であると考えられます。実際、この細胞に比較的強い照明光を当てながら長時間の定量的観察が可能となりました。標識コンデンシンⅠが、分裂期の核膜崩壊に伴い細胞質から遊走(移動)し、染色体に一斉に結合する様子を詳細に捉えることに成功しました(図6)。
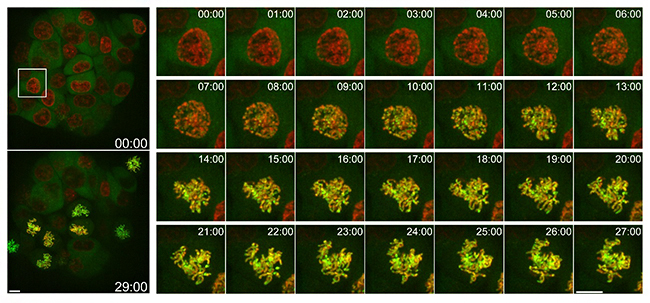
図6 コンデンシンⅠの有糸分裂染色体への結合様式
改良型tdStayGoldの一つtd5oxStayGoldを、ノックインゲノム編集を使ってヒト培養細胞(HCT116細胞)のコンデンシンⅠのC末端に融合した。体積イメージングを行い、対物レンズの光軸方向に沿って複数の画像を取得。それらを全部重ね合わせた画像を並べた。時間経過を白抜きで表示。実験時間は30分。左は低倍観察画像(スケールバーは10μm)。右は左上の画像における白四角で囲った領域の1分ごとの画像(スケールバーは10μm)。緑:td5oxStayGoldの蛍光。赤:DNAを標識したSiR-DNAの蛍光。
今後の期待
StayGoldの単量体を作製する過程で、この蛍光タンパク質本来の光安定性と明るさを保持するだけでなく、さらに向上させた変異体mStayGoldを得ることができました。部分的な変異の導入体の数多くを根気よく解析することで得られた成果です。さらに性能向上の余地がある一方で、今回は、アクチン線維やミトコンドリアのクリステの観察の時空間スケールを拡張することで、mStayGoldの分子や膜を標識する性能を実証することができました。分散性の高い改良型tdStayGoldに関しても、ノックインゲノム編集による内在性コンデンシンⅠの標識とその観察を通して有用性を示すことができました。
褪色は定量的蛍光観察における最重要課題です。経時的な観察や通常のzスキャン[12]を伴う体積イメージングでは、標本に繰り返し照射することで褪色が発生します。これに対して蛍光標識をひたすら明るくしシグナル量を稼ぐ対処法もありますが、許容量を超える蛍光タンパク質の過剰発現は、必然的に蛍光シグナルの氾濫や細胞機能の障害などの問題を起こします。蛍光タンパク質の発現の量的制御がもっと議論される必要があると考えられます。現在はゲノム編集技術により、本来のコピー数を反映する蛍光標識が可能となっています。一見、暗いと思われる蛍光標識産物を持続的に定量する観察技術が求められています。単価の標識を可能にするStayGold技術は、創薬研究など定量性を重視する分野で直ちに活用されると期待できます。
補足説明
1.褪色(たいしょく)
発色団は、可視域にある光を吸収することで色を作る構造単位である。褪色は発色団が分解することで起こり、その結果不可逆的に色が消失する。
2.分散性
タンパク質などの生体分子が液体中で均一に分布する性質。
3.発色団の先端
発色団とは、可視域の光を吸収する構造単位である。蛍光タンパク質は自身のペプチド部分から発色団を形成することができる。発色団の先端には、たいていの場合チロシンに由来するフェノール性水酸基が位置しており、この水酸基のイオン化状態が蛍光特性を決定する。
4.放射照度
単位面積当たりに入射する単位時間当たりの光放射エネルギー。
5.EGFP、mGreenLantern、mNeonGreen、mClover3
mClover3およびmGreenLanternはオワンクラゲ由来の蛍光タンパク質GFPを基に発色団形成効率を飛躍的に高めた変異体である。mNeonGreenはナメクジウオ由来の四量体蛍光タンパク質を基に開発された単量体蛍光タンパク質で明るさに定評がある。EGFPは大腸菌に発現させたGFPを精製・抽出することで蛍光強度を高めたもの。
6.絶対的明るさ
蛍光タンパク質がある波長の光を吸収して励起される能力(モル吸光係数)と、その後に蛍光を放出する割合(蛍光量子収率)を掛け合わせた値。試験管内での測定で決定される。
7.一分子追跡観察
高い時間的空間的分解能で、個々の標識された分子の移動(拡散)や結合(反応)などを直接的に追跡する観察。
8.蛍光タイムラプス観察
ある一定のタイムインターバルを設定し、間欠的に、蛍光画像を取得すること。
9.構造化照明顕微鏡(SIM)
構造化照明(高い空間周波数のパターン照明)で得られる干渉縞を利用して、微細構造情報を抽出する超解像顕微鏡。SIMはStructured Illumination Microscopyの略。
10.スピニングディスク型共焦点顕微鏡
マイクロレンズアレイディスクを介したマルチビームスキャンにより、励起光を多数の弱いビームに分散することで、高速イメージングを可能にする共焦点顕微鏡のこと。通常の共焦点顕微鏡はシングルビームスキャン。
11.ゲノム編集技術
生物が元々持つ性質を改変する技術。ゲノムDNAの特定の塩基配列を狙って変化させることで達成する。
12.zスキャン
z軸方向(対物レンズの光軸方向)に沿って焦点面をずらしながら画像を取得すること。
共同研究グループ
理化学研究所
脳神経科学研究センター 細胞機能探索技術研究チーム
光量子工学研究センター 生命光学技術研究チーム
チームリーダー 宮脇 敦史(ミヤワキ・アツシ)
研究員 安藤 亮子(アンドウ・リョウコ)
上級テクニカルスタッフ 杉山 真由(スギヤマ・マユ)
上級テクニカルスタッフ 黒川 裕(クロカワ・ヒロシ)
技師 平野 雅彦(ヒラノ・マサヒコ)
脳神経科学研究センター 細胞機能探索技術研究チーム
研究員 下薗 哲(シモゾノ・サトシ)
研究員 新野 祐介(ニイノ・ユウスケ)
放射光科学研究センター 生命系放射光利用システム開発チーム
チームリーダー 山本 雅貴(ヤマモト・マサキ)
専任研究員 吾郷 日出夫(アゴウ・ヒデオ)
専任技師 上野 剛(ウエノ・ゴウ)
開拓研究本部 今本細胞核機能研究室
専任研究員 高木 昌俊(タカギ・マサトシ)
生命機能科学研究センター 細胞極性統御研究チーム
チームリーダー 岡田 康志(オカダ・ヤスシ)
京都大学 アイセムス(高等研究院)物質-細胞統合システム拠点
特定准教授 藤原 敬宏(フジワラ・タカヒロ)
特任教授 石館 文善(イシダテ・フミヨシ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「共鳴誘導で革新するバイオイメージング(領域代表者:宮脇敦史)」「情報物理学でひもとく生命の秩序と設計原理(領域代表者:岡田康志)」、同基盤研究(S)「蛍光タンパク質の「明るさ」と「光安定性」に関する革新的開発研究(研究代表者:宮脇敦史)」、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」、同創薬等ライフサイエンス研究支援基盤事業「創薬等先端技術支援基盤プラットフォーム(BINDS)」の助成を受けて行われました。
原論文情報
Ryoko Ando, Satoshi Shimozono, Hideo Ago, Masatoshi Takagi, Mayu Sugiyama, Hiroshi Kurokawa, Masahiko Hirano, Yusuke Niino, Go Ueno, Fumiyoshi Ishidate, Takahiro Fujiwara, Yasushi Okada, Masaki Yamamoto, Atsushi Miyawaki, “StayGold variants for molecular fusion and membrane targeting applications”, Nature Methods, 10.1038/s41592-023-02085-6
発表者
理化学研究所
脳神経科学研究センター 細胞機能探索技術研究チーム
光量子工学研究センター 生命光学技術研究チーム
チームリーダー 宮脇 敦史(ミヤワキ・アツシ)
研究員 安藤 亮子(アンドウ・リョウコ)
脳神経科学研究センター 細胞機能探索技術研究チーム
研究員 下薗 哲(シモゾノ・サトシ)
京都大学 アイセムス(高等研究院 物質-細胞統合システム拠点)
特定准教授 藤原 敬宏(フジワラ・タカヒロ)
報道担当
理化学研究所 広報室 報道担当
京都大学 アイセムス コミュニケーションデザインユニット
担当:遠山 真理(トオヤマ・マリ)