2019-09-06 京都大学
佐々木克博 医学研究科講師、岩井一宏 同教授らの研究グループは、リンパ球(T細胞含む)が炎症を引き起こす新たなメカニズムを明らかにしました。
本研究では、本研究グループが作成したマウスを用いた実験から、皮膚組織に浸潤した僅かな活性化T細胞が、生理活性物質TNFαを介して皮膚表皮細胞の細胞死を惹起することで、皮膚の慢性炎症を引き起こす病態機序を初めて明らかにしました。
一般に、自己免疫疾患では炎症部位にリンパ球が存在しますが、今回発見した新たなタイプの炎症ではリンパ球はほとんど存在せず、むしろ好中球やマクロファージを含む自然免疫の細胞群が多く存在しており、このような炎症は、自然免疫系の過剰な活性化で引き起こされる疾患である「自己炎症性疾患」に特徴的なタイプです。
本研究成果は、慢性関節リウマチなどの抗TNFα抗体が著効を示す自己免疫疾患の病態形成の解明に繋がる重要な成果であると同時に、リンパ球非依存的に発症すると考えられている自己炎症性疾患群の発症要因にT細胞が関与している可能性も示唆しています。
本研究成果は、2019年8月28日に、国際学術誌「Nature Communications」のオンライン版に掲載されました。
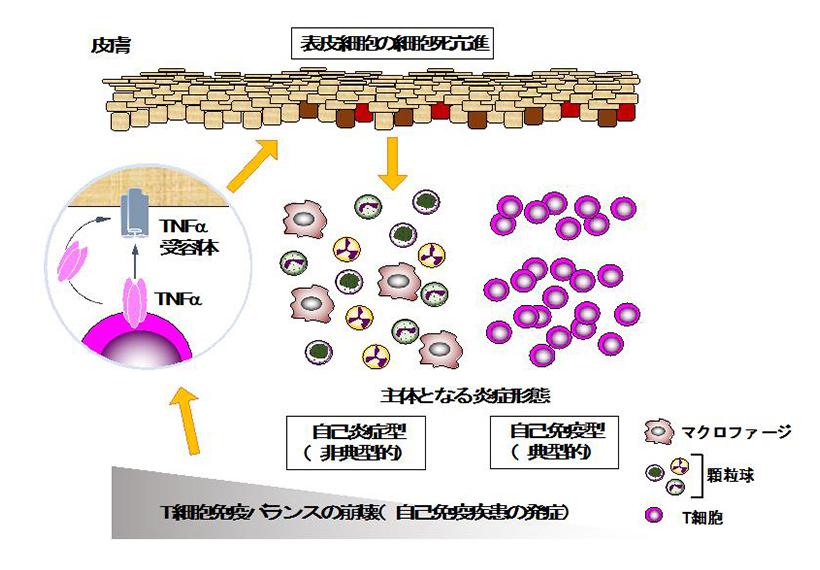
図:本研究の概要図
書誌情報
【DOI】 https://doi.org/10.1038/s41467-019-11858-7
【KURENAIアクセスURL】 http://hdl.handle.net/2433/243883
Katsuhiro Sasaki, Ai Himeno, Tomoko Nakagawa, Yoshiteru Sasaki, Hiroshi Kiyonari & Kazuhiro Iwai (2019). Modulation of autoimmune pathogenesis by T cell-triggered inflammatory cell death. Nature Communications, 10:3878.
詳しい研究内容について
自己免疫疾患の新たな病態発症メカニズムを解明
―炎症性疾患における T 細胞の新たな役割―
概要
自己免疫疾患は、免疫細胞のリンパ球(T 細胞やB細胞を含む)が過剰に活性化することで発症します。京 都大学大学院・医学研究科の佐々木克博講師、岩井一宏教授らの研究グループは、リンパ球が炎症を引き起こ す新たなメカニズムを明らかにしました。本研究では、当研究チームが作成したマウスを用いた実験から、皮 膚組織に浸潤した僅かな活性化 T 細胞が、生理活性物質 TNFαを介して皮膚表皮細胞の細胞死を惹起するこ とで、皮膚の慢性炎症を引き起こす病態機序を初めて明らかとしました。一般に、自己免疫疾患では炎症部位 にリンパ球が存在しますが、今回発見した新たなタイプの炎症ではリンパ球はほとんど存在せず、むしろ好中 球やマクロファージを含む自然免疫の細胞群が多く存在しており、このような炎症は、自然免疫系の過剰な活 性化で引き起こされる疾患である「自己炎症性疾患」に特徴的なタイプです。
本研究結果は、慢性関節リウマチなどの抗 TNFα抗体が著効を示す自己免疫疾患の病態形成の解明に繋が る重要な成果であると同時に、リンパ球非依存的に発症すると考えられている自己炎症性疾患群の発症要因に T 細胞が関与している可能性も示唆しています。
本研究成果は、2019 年 8 月 28 日に、英国の国際学術誌「Nature Communications」にオンライン掲載され ました。
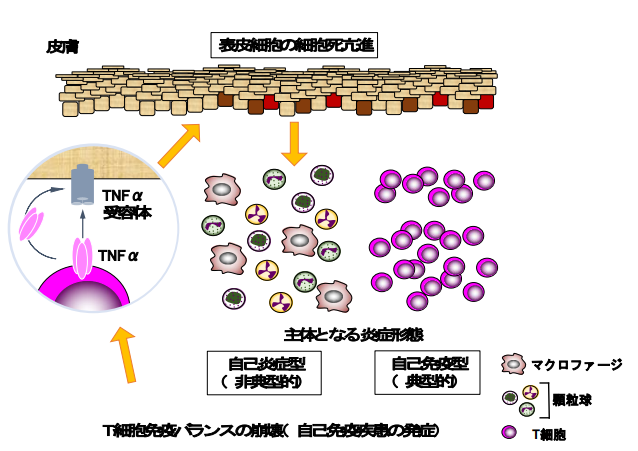
1.背景
免疫が引き起こす炎症性疾患は、リンパ球などを含む獲得免疫システムが原因となる「自己免疫疾患」と、 自然免疫システムや炎症性サイトカインの過剰産生が原因となる「自己炎症性疾患」の大きく二つに分けられ ます。Sharpin 遺伝子を原因遺伝子とする突然変異マウス cpdm は重篤な皮膚炎を発症することが知られてい ます。Sharpin は HOIP、HOIL-1L と呼ばれるタンパク質とともに複合体型酵素 LUBAC を形成して直鎖状ユ ビキチン鎖を生成することで細胞などの活性化、細胞死の抑制に寄与するタンパク質です。cpdm は Sharpin が欠損しているために LUBAC が著減してしまい、皮膚炎を発症します。
これまで皮膚炎の発症は、TNFαなどのサイトカイン(細胞から分泌される生理活性タンパク質)によって 皮膚を構成する細胞(特に表皮細胞)の細胞死が亢進することが原因とされており、また病巣部にリンパ球の 存在や自己免疫疾患の特徴の 1 つである自己抗体が認められないことなどから、自己炎症性の皮膚炎であると 考えられてきました。
一方で当研究チームは、詳細な解析から、cpdm マウスでは T 細胞を中心とした獲得免疫システムにも異常 があることを見出していましたので、自己免疫性の炎症メカニズムも発症している可能性が想定されました。 本研究は、cpdm の皮膚炎が自己免疫疾患と自己炎症性疾患という二つの異なる要因から形成されているのか という疑問点を解決するために着手しました。しかし、その過程で図らずも、T 細胞が自然免疫系を活性化さ せて自己炎症性疾患様の炎症を起こすことができる病態機序を明らかにできました。
2.研究手法・成果
cpdm の皮膚炎は皮膚表皮細胞(ケラチノサイト)の細胞死の亢進がその主因であると考えられていたので、 皮膚表皮細胞のみで Sharpin を欠損させたマウス(Sharpin Skin-KO)を作成しました。予想通り cpdm と同 様の表皮細胞の細胞死とそれに基づく慢性皮膚炎を発症したことから、従来考えられていたように、cpdm の 皮膚炎は自己炎症性である可能性が示唆されました。一方、T 細胞の関与を明らかにするためにT細胞だけで Sharpin を欠損するマウスを作成したところ、ほとんどのマウスは正常でしたが、約 10%は皮膚炎を発症しま した。T 細胞は炎症を誘導するタイプと抑制するタイプの細胞に分けられ、免疫機能の恒常性を保つため、お 互いは常に機能的な均衡を維持する必要があります。そこで、約 10%のマウスのみが症状を呈する理由を追 及すべく、炎症を抑制するタイプの T 細胞である制御性 T 細胞のみで Sharpin を欠損させたところ(Sharpin T-KO)、T 細胞全てで欠損させた場合とは異なり、全てのマウスが皮膚炎を発症しました。LUBAC は T 細胞 の活性化にも関わりますので、この結果は Sharpin の欠損で制御性 T 細胞の機能が低下して免疫バランスの 恒常性が崩れ、炎症を誘導するタイプの T 細胞が活性化することが原因で皮膚炎が発症することを示してい ます。つまり、cpdm では、自己炎症性(皮膚の細胞死が主体となる炎症)と自己免疫性(T 細胞が主体とな る炎症)の2つの異なる機序が両方とも関わって皮膚炎を発症している可能性が考えられました。
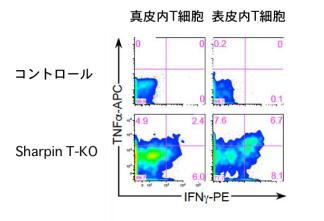
自己免疫疾患はリンパ球が炎症を起こすので病巣にはリンパ球が浸潤しています。しかし、制御性 T 細胞特 異的な Sharpin 欠損マウス は T 細胞が主因で炎症が起きるにもかかわらず、皮膚にはリンパ球ではなく、 cpdm や皮膚特異的 Sharpin 欠損マウスと同様にマクロファージや好中球といった自然免疫系の細胞群が浸潤 していました。加えてアポトーシス及びネクロプトーシスと呼ばれる複数の細胞死が表皮細胞で起きており、 あたかも自己炎症性の病気である様な所見を示していました(図1)。T 細胞が cpdm 由来の細胞の細胞死を 誘導できることを培養実験系を樹立して調べたところ、TNFα標的薬で細胞死が抑制できることが判りました。 さらに、制御性 T 細胞特異的 Sharpin 欠損マウスの皮膚内では、僅かではありますが、TNFα陽性の T 細胞 (CD69+CD103+組織常在性記憶型)が特異的に存在していたので、この T 細胞群が TNFαを介して表皮細 胞の細胞死を誘導している可能性が強く示唆されました(図2)。LUBAC はアポトーシス、ネクロプトーシ スと呼ばれる細胞死を抑制します。TNFαやネクロプトーシスの実行因子である RIPK3 の欠損マウスと Sharpin T-KO を交配すると、Sharpin T-KO の皮膚炎の重症度が著しく抑えられました。以上の結果から、 Sharpin T-KO で誘導されるT細胞依存的な皮膚炎は、T 細胞が発現している TNFαによる表皮細胞の細胞死 が引き金となって発症する自己炎症性疾患のような機序で生じる炎症であることが明らかとなりました。
LUBAC は 3 つのタンパク質から構成されており、Sharpin を欠損すれば LUBAC の量は顕著に減少します が、もう 1 つの構成分子である HOIP の量を半分にすれば、LUBAC の量はさらに減少します。そこで、制御性 T 細胞の機能をさらに低下させて、炎症を誘導するタイプの T 細胞をさらに活性化させる目的で、制御性 T 細 胞特異的に Sharpin を完全に消失し、HOIP が半分の量になったマウスを作成しました。そのマウスも皮膚炎 を生じましたが、炎症を起こしている主たる細胞はマクロファージや好中球ではなくリンパ球であり、自己免 疫疾患と診断できる皮膚炎でした。しかし、同時に皮膚表皮細胞の細胞死も観察されたので、自己炎症と自己 免疫の両方が混在している炎症であると考えられました。T 細胞が引き起こす炎症は自己免疫疾患と定義され ますが、今回の我々の発見は、T 細胞は複数の経路で炎症を生じさせることができ、場合によってはあたかも 自然免疫系の異常な活性化によって生じるような炎症も起こし得ること、その機序の 1 つは T 細胞が惹起す る細胞死誘導性であることを証明しました。加えて、今回の発見は獲得免疫系の細胞である T 細胞が過剰に活 性化されるだけで、自然免疫系をも活性化させ、自己免疫疾患を起こせることを明確にしました。
3.波及効果、今後の予定
リンパ球である T 細胞が自己を傷害する炎症は、病巣にリンパ球が浸潤する自己免疫疾患であると考えら れてきました。しかし本研究の成果から、T 細胞はリンパ球非依存性と考えられる自己炎症性疾患と診断さ れるような自己を傷害する炎症にも関与する可能性が明らかになりました。自己免疫疾患である慢性関節リ ウマチでは抗 TNFα抗体が著効を示しますが、それらの自己免疫疾患の病態形成に今回発見した経路が関与 している可能性が高く示唆されます。さらに、病因が明らかに異なる疾患であっても、見かけ上類似した様 相を示す疾患が存在することを実験的に明確に証明することが出来ました。本研究結果に加えて、他の自己 免疫疾患モデルや炎症モデルにおいて、見出した新規炎症メカニズムの存在を改めて解析することが今後の 課題であると考えております。
4.研究プロジェクトについて
本研究は理化学研究所と共同で行われたものです。また、本研究プロジェクトは、日本学術振興会・新学術 領域研究「直鎖状ポリユビキチン鎖の選択的生成機構とその役割」、日本学術振興会・基盤研究 A「直鎖状ポ リユビキチン鎖生成リガーゼの機能とその異常による疾患発症機構」、日本学術振興会・挑戦的萌芽研究「NFκB を制御する直鎖状ユビキチン鎖生成調節薬の開発」、日本学術振興会・基盤研究 S「直鎖状ユビキチン鎖 を生成する LUBAC リガーゼの統括的研究」、日本学術振興会・若手研究 B「LUBAC 欠損型自己炎症性疾患 における抗炎症性 T 細胞の同定と機能解析」、日本学術振興会・若手研究「ネクロプトーシス誘導を介した T 細胞依存性自己炎症病態機構の解明」のご支援によって遂行されました。
<研究者のコメント>
本研究は主にマウス個体を用いて得られた成果ですが、Sharpin が自己免疫疾患と自己炎症性疾患の両者の 重要な原因遺伝子であること、LUBAC という複合体の構成因子であり、それらの遺伝子改変マウスが利用で きたことが、研究の幅を広げてくれました。近年、海外では多系統の遺伝子改変マウスの交配による動物実験 が進んでいますが、入手や維持の面で国内では同様の実験は困難と感じております。マウスの導入・作成を含 め容易な利用環境が今後整ってくれることを望みます。
<論文タイトルと著者>
タイトル:Modulation of autoimmune pathogenesis by T cell-triggered inflammatory cell death(T 細胞に よる細胞死起因性炎症プロセスが多様な自己免疫病理像を創り出す)
著 者:Katsuhiro Sasaki, Ai Himeno, Tomoko Nakagawa, Yoshiteru Sasaki, Hiroshi Kiyonari, and Kazuhiro Iwai
掲 載 誌:Nature Communications DOI:10.1038/s41467-019-11858-7
<参考図表>
図 1. 表皮細胞の細胞死検出
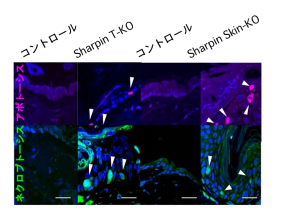
図 2.皮膚浸潤 T 細胞における TNF の発現解析