2023-12-01 量子科学技術研究開発機構
要点
- 単一高分子が「自己折りたたみ」する新技術を用い、現行の医療用MRI造影剤の7倍もの性能(緩和能)を持つナノ粒子を開発した。
- 新技術によって、がん集積性能、診断性能そして安全性を同時に向上させた。また、重金属の環境への排出を、大きく低減できる可能性がある。
- MRI造影剤として高い解像度で腫瘍内部の分布を捉え、その場所を狙って同時に治療薬として中性子捕捉がん治療ができ、将来の「高精度医療」の基盤技術になり得る。
概要
東京工業大学 科学技術創成研究院 化学生命科学研究所の三浦裕准教授と西山伸宏教授、高山(Gao Shan)大学院生らの研究チームは、量子科学技術研究開発機構(QST) 量子医科学研究所の青木伊知男上席研究員、長田健介グループリーダーらの研究グループならびに川崎市産業振興財団 ナノ医療イノベーションセンター(iCONM)(用語1)と共同で、がんの高精度MRI診断と中性子捕捉がん治療(用語2)を同時に実施できる新規高分子MRI造影剤を開発した。
乳がんや脳腫瘍などの検査に必須なMRI用造影剤は、従来品では環境毒性のあるガドリニウムという重金属を500〜1,000 mMもの高濃度で投与する必要があり、副作用や体内残留のリスクに加えて、自然環境への負荷の可能性があるため、減量化や代替物質の必要性が指摘されている。
本研究では、親水性部位と疎水性部位からなる新規高分子の精密合成によって、一本の高分子が水中で自発的に折りたたまれる現象「自己折りたたみ」を誘起させることで、ナノ粒子(用語3)化に成功した。この粒子は高分子の10 nm以下で、既存の多くのナノ粒子よりも極めて小さく、膵臓がんなど難治性が高いがんへの集積が期待できる。また、折りたたまれた高分子鎖中にMRIの造影分子を封じ込めることで緩和能(用語4)が向上し、少ない投与量でもがんを検出できる優れた造影効果を維持することも実証した。これにより下水に廃棄される重金属が削減され、自然環境への負荷軽減につながる。
さらに、マウスを用いた実験により、本研究で開発された薬剤はがん選択的に高濃度に送達ができ、MRIによる高解像度な分布の可視化も可能であることを確認した。このことは、近年注目されている中性子捕捉がん治療の課題となっていた、中性子と反応するホウ素が腫瘍全域に確実に集まっているかの判定に貢献するものである。
本研究成果は、新しい原理に基づく高精度のがん診断薬の創出基盤となるだけでなく、MRイメージングによるガイドを介した中性子捕捉療法の実施、すなわち一つの薬剤で診断と治療を同時に達成できるセラノスティクス薬剤への展開も期待される。
本研究成果は、材料科学、物理学、化学、医学、生命科学、工学の基礎および応用研究において高水準の研究成果が掲載される学術誌「Advanced Science」(インパクトファクター: 17.521)に11月29日付で掲載された。
背景
MRI造影剤は、環境毒性のあるガドリニウム金属錯体を500〜1,000 mMもの高濃度での静脈投与が必須であり、常に副作用や体内残留のリスクが懸念され(2017年:[薬生安発 1128 第2号])、加えて環境負荷の懸念も示されている(Environ. Sci. Technol. 2016, 50, 8, 4159–4168)。また、精度の高い診断を行うために造影剤の投与が望まれる場面でも、安全性の面からその実施に慎重になるケースも増えており、診断能の低下も懸念される状況である。そのため、より安全、かつ、より精密な診断を実現可能とする「患者にも、医療従事者にも、そして環境にもフレンドリーなMRI造影剤」の開発が社会的に求められている。
研究成果
本研究チームは今回、高分子精密合成に基づき、高分子1分子内での自発的な折りたたみ(self-folding)を駆動力として形成する新規高分子造影剤(SMDC-Gd、特願2023-124868)を開発した(図1)。SMDC-Gdは現行のMRI造影剤よりも7倍の性能(緩和能)を達成し、投与量の大幅な削減、あるいは腫瘍などの検出感度を高めることが確認できた。(図2a)。これは「自己折りたたみ」に伴うナノ環境下での金属分子回転速度の制御(図2b)に起因するもので、我々はこれを「フォールディング効果」と命名した。また、造影剤の性能を向上させる新原理の発見だけでなく、SMDC-Gdは、疾患部位への選択的な集積と速やかな腎排泄、脳に集積しないなど、従来品を上回る性能と安全性を兼ね備えていることも確認できた(図3)。さらに、このSMDC-Gdを用いて腫瘍の中性子捕捉療法を試みた結果、従来の中性子照射のみの治療を行った群やMRI造影剤を投与した群と比較して、SMDC-Gd投与群に統計的に優位な治療効果の上昇も確認できた(図4)。
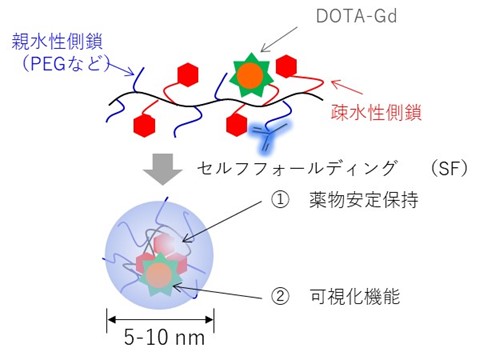
図1 開発した新規高分子造影剤(SMDC-Gd)
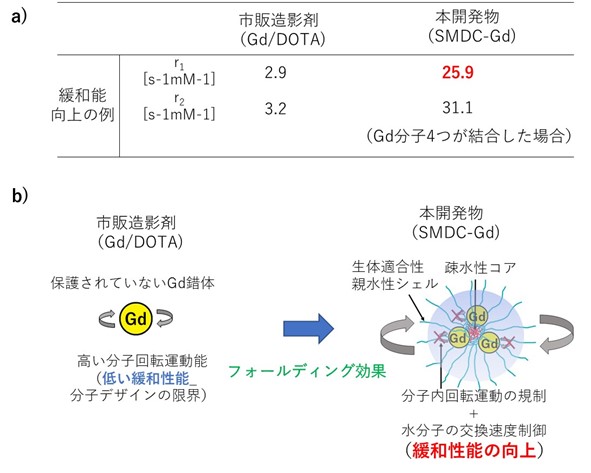
図2 市販製剤と比較した本開発物の優位性
a) 緩和能の違い、b) SMDC-Gdにおけるフォールディング効果と緩和性能向上メカニズム
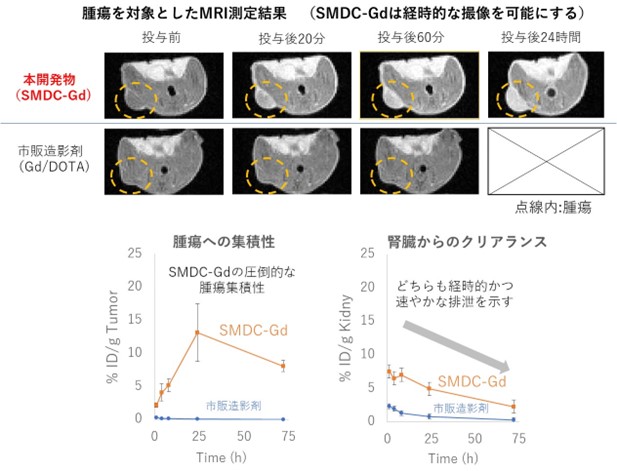
図3 本開発物のMRI測定結果と市販製剤と比較した場合の腫瘍集積ならびに腎クリアランス(CT26大腸がん皮下移植モデルマウスを使用)
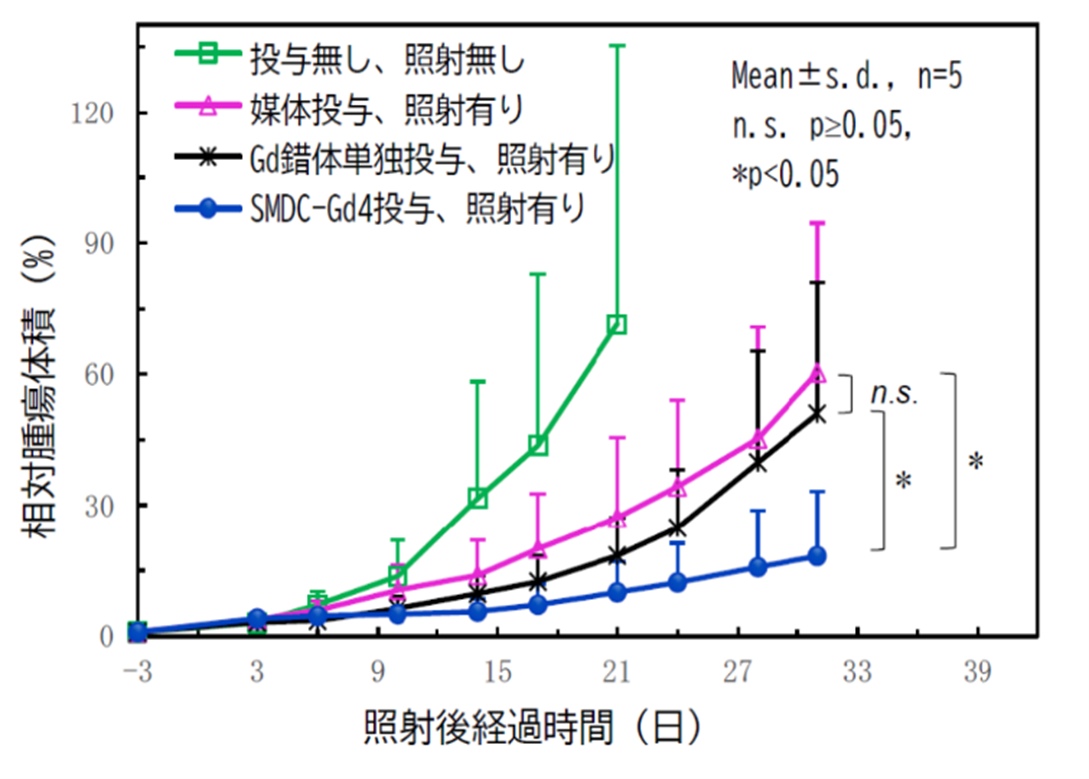
図4 SMDC-Gdを用いた中性子捕捉療法における腫瘍の増殖抑制効果(CT26大腸がん皮下移植モデルマウスを使用)
社会的インパクト
医療現場で使用されている既存MRI造影剤としては、これまでに環状Gd錯体や直鎖Gd錯体が開発されている。国内では環状Gd錯体が主要製剤となっている。しかし、これら多くの既存造影剤には、高濃度に起因する免疫反応や、腎障害の患者に対する腎性全身性線維症、手術後の脳や骨へのGd蓄積などのリスクが指摘されている。現状、現在までにその代替となる造影剤は存在せず、医療現場への提供も予定されていない。
加えて、既存MRI造影剤は自然環境に対して負荷をかけている可能性もある。成人男性一人あたり3,870 mg、2018年の調査で国内では年間127万回の造影検査が行われているため、全国で年間4.5トンもの強い毒性を持つ重金属が、下水を通じて自然界に排出されている。造影剤に使用されている重金属ガドリニウムは、生体内では錯体構造に包まれることで多くの場合で安全だが、下水への排出後にガドリニウム・イオンが遊離すると強い生物毒性を生じる。2016年のサンフランシスコ湾の土壌調査でガドリニウム濃度は、1993年の23.2 pmol/kgから2013年には171.4 pmol/kgと7倍以上の増加が報告され(Environ. Sci. Technol. 2016, 50, 8, 4159–4168)、東京周辺の河川でも同様の報告があるなど、環境負荷が懸念されているが、適切な代替手法がないこと、そして医療上の必要性から使用せざるをえない状況となっている。
したがって、人体にも環境にも、より低用量での使用が望まれ、また安全で有用な代替元素での造影剤が開発された場合は、既存の造影剤が全て置き換わるほどのインパクトが存在する。さらに本MRI造影剤のように投与後の疾患選択性と対外排出の同時制御が可能な場合は、患者に対するQOLや安全性の点からも極めて大きな貢献が可能である。MRI造影剤の開発は低分子錯体が中心となっており、現在も各国で臨床試験が進められているが、MRIの造影に重要な緩和能は未だに十分に高くない状況である。一方、本開発は一本鎖高分子から構成される10 nm以下の新規ナノMRI造影剤であり、低用量化による環境負荷の軽減、将来的にはガドリニウムをより安全な代替元素に置き換え、かつ性能を維持するという現行MRI造影剤の課題を解決できる要素技術になると考えている。
また、MRIによる高解像イメージングと中性子捕捉がん治療を組み合わせた高精度医療の実現も期待できることからも社会的なインパクトは非常に大きいものと考えられる。なお、MRI造影剤の世界市場規模は、途上国での高精度診断装置の導入に伴い2022年の29億8,000万米ドル(4,496億円)から2030年には55億8,000万米ドル(8,415億円)に拡大が予想されている(Value Market Research社)。
付記
本研究の一部にはJST共創の場形成支援プログラム「レジリエント健康長寿社会の実現を先導するグローバルエコシステム形成拠点」、文部科学省科学研究費助成事業 基盤研究(A)(21H04966)および国際共同研究加速基金の支援を受けた。MRI実験に関しては、文部科学省先端研究基盤共用促進事業「研究用MRI共有プラットフォーム」の支援を受けた。
用語解説
(1)ナノ医療イノベーションセンター(iCONM):
川崎市川崎区殿町の国際戦略拠点(キングスカイフロント)におけるライフサイエンス分野の拠点形成の核となる先導的な施設として、文部科学省より「地域資源等を活用した産学連携による国際科学イノベーション拠点整備事業」の支援を受け、川崎市、公益財団法人川崎市産業振興財団が整備を進め、2015年4月に運営を開始した研究センターである。産学官が一つ屋根の下に集い、異分野融合体制で革新的課題の研究および研究成果の実用化に取り組む。片岡一則センター長は、2023年、英国・クラリベイト社のデータ解析に基づきノーベル賞級の研究成果を創出する研究者を表彰するCitation Laureates™(引用栄誉賞)に選出された。
(2)中性子捕捉がん治療:
生体に安全な熱中性子線とがん組織に取り込まれた中性子との反応断面積が大きい元素との核反応により発生する放射線によって、選択的にがん細胞を殺傷する原理に基づくがん治療法。この治療法に用いられる中性子増感元素としては10B、157Gd等が考えられているが、現在はホウ素のみが臨床応用されている。また、ホウ素を放射性物質で標識して画像化するFBPA-PETという方法と組み合わせた治療が行われつつあるが、現在の臨床用PETイメージング装置の解像度が数ミリ程度に留まるため、がん内部での高解像度での分布確認が困難であるという課題が未解決である(がん全域にホウ素が十分な濃度で到達しなければ、治療が不完全となるリスクが高くなる)。
(3)ナノ粒子:
1ミリメートルの1,000分の1が1ミクロン(µm)、さらにその1,000分の1が1ナノメートル(nm)である。ナノ粒子は1〜100 nm程度の粒子径を持つ微小な粒子をいう。近年、ナノ粒子を用いた医療への応用が多数開発され、特に、薬剤送達システム(ドラッグデリバリーシステム、DDS)と呼ばれる薬剤を体内で運搬する担体として注目が集まっている。薬や核酸の効果を上げ、副作用を減らすために、ターゲットとなる細胞や組織に効率的に薬を到達させ、必要量をタイミングよく放出させるシステムで、ナノ粒子を用いたDDSを「ナノDDS」あるいは、高機能化されたものを「ナノマシン」と呼称することがある。
(4)緩和能:
MRIは体内の水(H2O)の「水素の原子核」を観察する方法である。緩和能とはMRIを撮影する際に使用される造影剤が信号を変化させる性能をいう。MRIは生体組織中の水の緩和時間(T1、T2)を短縮させて、異なる組織間のコントラストを増強し、病変部位を検出するイメージング法である。緩和能が高いほど、少量の造影剤の投与で済み、あるいは同じ量でより小さな病変を見つけることができる。一般的に、MRIやCTで使用される造影剤は非常に高い濃度と量であるため、稀に副作用としてショックやアナフィラキシー、頭痛、吐き気などが生じる場合があり、性能を維持した上での低用量化が求められているが、30年以上に渡って、その課題は解決されていない。
論文情報
掲載誌:Advanced Science
論文タイトル:Self-folding Macromolecular Drug Carrier for Cancer Imaging and Therapy
著者:Shan Gao, Yutaka Miura, Akira Sumiyoshi, Satoshi Ohno, Keisuke Ogata, Takahiro Nomoto, Makoto Matsui, Yuto Honda, Minoru Suzuki, Megumi Iiyama, Kensuke Osada, Ichio Aoki, Nobuhiro Nishiyama
DOI:10.1002/advs.202304171