2020-04-14 理化学研究所
理化学研究所(理研)脳神経科学研究センタータンパク質構造疾患研究チームの田中元雅チームリーダー、志田俊信研修生・大学院生リサーチ・アソシエイト(研究当時)らの国際共同研究グループは、生体内に存在する可溶性プリオンタンパク質[1]の短い天然変性領域[2]における特定の揺らいだ構造が、異種間でのプリオン感染効率の制御に関与していることを明らかにしました。
本研究成果は、これまでに不明な点が多かった、神経変性疾患[3]の患者脳で生じる異なるタンパク質間での共凝集の理解に役立つと期待できます。
ウシからヒトへの「プリオン病[4]」の感染がまれなように、プリオンタンパク質のごく少数のアミノ酸配列の違いによって、異種間でのプリオン感染性は大きく減少します。このような現象は「種の壁」として知られていますが、その分子機序は分かっていませんでした。
今回、国際共同研究グループは、二つの遠縁種由来の酵母のSup35プリオンタンパク質(Sup35)を用いて、Sup35における短い天然変性領域を調べました。その結果、可溶性Sup35の短い天然変性領域において、少数のアミノ酸残基を置換することにより、局所的に動きと構造が変化し、異種間プリオン感染が生じることを見いだしました。さらに、このような短い天然変性領域内においては、メチレン基(=CH2)の有無というアミノ酸側鎖間のわずかな構造の違いでさえ、短い天然変性領域の構造を大きく変化させ、異種由来のプリオンタンパク質凝集体[5]との凝集反応(感染効率)を制御することを明らかにしました。
本研究は、科学雑誌『Nature Chemical Biology』の掲載に先立ち、オンライン版(4月13日付:日本時間4月14日)に掲載されます。
背景
哺乳類が患う神経変性疾患の中で、「プリオン病」はプリオンタンパク質を介した感染性を示すという大きな特徴があります。ウシからヒトへのプリオン病の感染がまれなように、プリオンタンパク質のごく少数のアミノ酸配列の違いによって、異種間でのプリオン感染性は大きく減少します。ウシからヒトへの異種間のプリオン感染は、生体内に存在する可溶性プリオンタンパク質が、異種由来のプリオンタンパク質凝集体と偶発的に凝集反応することで引き起こされると考えられています。このような現象は「種の壁」として知られていますが、体内の可溶性プリオンタンパク質が、どのように異種間のプリオン感染効率を制御しているかは不明のままでした。
そこで、国際共同研究グループは、これまでプリオン感染現象の解明に大きく貢献してきた酵母プリオンタンパク質の実験系を用いて、種の壁を越えるプリオン感染の分子メカニズムの問題に取り組むことにしました。その際、これまでの哺乳類および酵母プリオン感染研究では、近縁種由来のタンパク質(アミノ酸配列の類似性が高い)が用いられてきましたが、本研究では二つの遠縁種由来のタンパク質(アミノ酸配列の類似性が低い)を用いることで、種の壁の分子構造基盤がより明らかにできるのではないかと考えました。
また、異種由来のプリオンタンパク質凝集体ではなく、生体内に存在する可溶性プリオンタンパク質を調べることで、感染性の制御機構についての知見が得られるのではないかと考えました。
研究手法と成果
国際共同研究グループは、S. cerevisiae(SC)およびK. lactis(KL)という二つの遠縁酵母種由来のSup35プリオンタンパク質を用いて研究を行いました。これまでのSup35タンパク質研究においては、SCを用いた研究が長らく行われ、プリオン感染時の表現型などの判別がより確立されています注1-3)。このような経緯を踏まえて、上記2種の酵母を用いた感染研究を進めるにあたっては、SCを感染される側と設定しました。また、この2種間での感染メカニズムを調べる上で、SCに内在する可溶性Sup35タンパク質が、どのようにKL由来のSup35タンパク質凝集体との反応性を獲得するか調べました。
可溶性Sup35タンパク質の凝集形成に関わる領域は天然変性であり、特定の折り畳まれた立体構造をとりません。このような構造上の特性を持つタンパク質を用いて異種間プリオン感染解析を行うため、高分解能の核磁気共鳴(NMR)法[6]実験を中心に、試験管内での系統的な遺伝子変異解析、酵母を用いた生体内でのプリオン感染実験、分子動力学計算[7]を用いたシミュレーションなどの多様な研究手法を取り入れました。
まず、SCとKL由来の可溶性Sup35タンパク質の動きを、NMR測定法による速い時間スケールの構造揺らぎを観察できる1H-15N異種核NOE測定[8]によって比較したところ、動きが大きく異なっている短い領域が存在することが分かりました(図1)。この領域は、凝集体形成の中心部位として知られるアミノ末端の約70アミノ酸残基内に存在しており、同じタンパク質であっても、種が異なると局所的に違いが存在することを示しています。
- 注1)2018年3月22日プレスリリース「アミロイド構造の多様性の原因解明」
- 注2)2010年1月18日プレスリリース「酵母プリオンタンパク質のオリゴマー形成過程が感染強度を決定」
- 注3)理研ニュース2019年12月号研究最前線p6「タンパク質の凝集体から脳疾患を解明する」
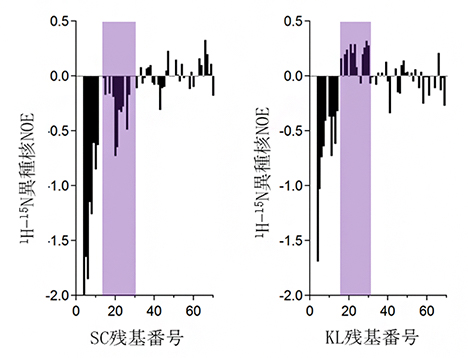
図1 遠縁酵母由来の可溶性のSup35タンパク質の短い天然変性領域における動きの違い
アミノ末端の70アミノ酸残基におけるSC(左)およびKL(右)Sup35タンパク質の1H-15N異種核NOE値。それぞれの残基について、正のNOE値は遅い動き、負のNOE値は速い動きを示す。二つのタンパク質の動きを比較すると、紫で示したSC残基14~30およびKL残基16~31において、動きが大きく異なることが分かる。なお、欠落している残基は、プロリンまたは重複している残基か、正確に定量化するにはシグナルが弱い残基を示す。
このようなSup35タンパク質の局所的な動きの違いが感染性に関係しているのかを調べるために、SC由来のSup35タンパク質の動きが大きく異なっていた領域内において、KL由来の同領域のアミノ酸残基に置換したキメラタンパク質[9]を作製しました。その結果、たった5アミノ酸残基の置換だけでも、局所的に動きと構造がKL由来の可溶性Sup35タンパク質のように変化し、試験管内および酵母内での異種間プリオン感染が生じることを見いだしました。さらに、このようなアミノ酸置換を含んだ短い天然変性領域内においては、メチレン基(=CH2)の有無というアミノ酸側鎖間のわずかな構造の違い(グルタミンとアスパラギンの違い)でさえ、短い天然変性領域の構造を大きく変化させ、KL由来のプリオンタンパク質凝集体との凝集反応を制御できることが明らかになりました(図2)。
以上の結果から、生体内に存在する可溶性Sup35タンパク質に含まれる短い天然変性領域での特定の揺らいだ構造が、遠縁種由来の異種間プリオン感染効率を高度に制御していることが明らかになりました。
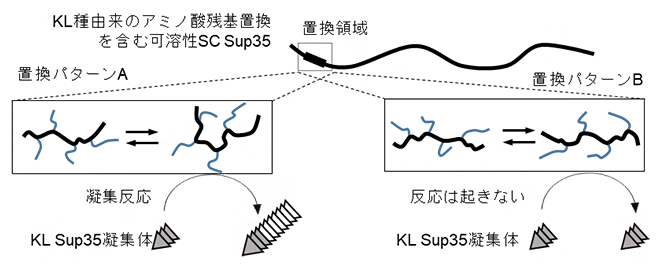
図2 局所的な構造の動きが種特有タンパク質凝集体への反応性を制御するモデル図
可溶性のSC由来Sup35タンパク質の短い天然変性領域を、KL由来Sup35タンパク質が持つアミノ酸配列に置換したキメラタンパク質を用いて研究を行なった。その結果、置換パターンA(左)とB(右)に代表されるように、5アミノ酸残基置換領域内の1カ所のアミノ酸側鎖のメチレン基(=CH2)の有無の違い(Aではグルタミン、Bではアスパラギン)で反応性が大きく異なるタンパク質を見いだした。黒線はアミノ酸の主鎖、青線はアミノ酸側鎖を示す。これらのアミノ酸配列は非常に類似しているものの、置換パターンAではKL由来Sup35タンパク質凝集体との凝集反応が起こるがBでは起きないといった、KL由来Sup35タンパク質凝集体に対しての反応性(感染効率)が大きく異なるという結果を得た。
今後の期待
本研究成果は、酵母におけるプリオン感染現象の解明にとどまらず、哺乳類におけるプリオン感染現象である種の壁の解明に貢献すると期待できます。酵母プリオンタンパク質Sup35と異なり、哺乳類におけるプリオンタンパク質は折り畳まれた立体構造を取っていますが、10残基程度の短いループ構造[10]の天然変性領域を含んでいます。これまでの研究では、このループ構造が哺乳類種間においてわずかに異なっていることが示され、異種間プリオン感染に関与していることが示唆されてきました。しかし、このような微細な構造の違いがどのように異種間プリオン感染性を制御しているかは、十分に理解されていませんでした。本研究により一つのメチレン基の違いのみで天然変性領域の立体構造が変化し、異種間プリオン感染性を変化させることが明らかになったため、上記に述べたループ構造領域の小さな違いが哺乳類におけるプリオンの感染性を高度に制御している可能性が示されました。
より広義には、神経変性疾患において頻繁に観察されている、異なるタンパク質間での共凝集反応の理解に役立つと期待できます。これらの疾患に関連するタンパク質の多くは、凝集してない状態では天然変性領域を含む一方で、凝集する際は異なるタンパク質と共凝集することがしばしば観察されてきました。本研究成果は、そのような可溶性の状態のタンパク質が、異なるタンパク質凝集体と共凝集反応を起こし、神経変性疾患を引き起こす現象の理解にも役立つと期待できます。また、このような異なるタンパク質間での共凝集反応は、生体内で有害な影響を与える可能性があるため、それらのタンパク質内の天然変性領域の構造は、疾患予防の効果的な治療標的になりうると考えられます。
補足説明
1.プリオンタンパク質
プリオンとはタンパク質からなる遺伝因子であり、プリオンを構成するタンパク質のことをプリオンタンパク質と呼ぶ。哺乳類では、狂牛病などの原因となる哺乳類のプリオンタンパク質(PrP)が知られている。出芽酵母では、Sup35やUre2などのプリオンタンパク質が知られている。
2.天然変性領域
αヘリックスやβシートなどの二次構造をとらないアミノ酸領域を示す。
3.神経変性疾患
神経組織の変性を伴う病気で、異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起こると考えられている。アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)およびプリオン病などが知られている。
4.プリオン病
脳内にプリオンタンパク質の凝集体が沈着し、神経細胞が変性する、現在まで有効な治療法が見つかっていない神経変性疾患。プリオンタンパク質の凝集体を感染源として、感染性を持つ。
5.タンパク質凝集体
変性したタンパク質、または折り畳み途中で異常が起こったタンパク質同士が寄り集まることでできる塊。アミロイドともいう。タンパク質としての本来の機能を持たず、神経変性疾患など病気の原因となると考えられている。
6.核磁気共鳴(NMR)法
静磁場に置かれた原子核の共鳴を測定し、分子の構造や運動状態などの性質を調べる分光法。NMRはNuclear Magnetic Resonanceの略。
7.分子動力学計算
多体粒子の時間発展を、ニュートン方程式やランジュバン方程式を数値的に解いて求める方法。材料科学や生体分子などさまざまな系で用いられている。
8.1H-15N異種核NOE測定
1Hと15N核の核オーバーハウザー効果を測定することで、観測している分子の動きを調べる方法。
9.キメラタンパク質
異なるタンパク質のある相同的なドメインを入れ替えることでできるタンパク質。
10.ループ構造
ループ構造は、折り畳まれたタンパク質の中で、αヘリックスやβシートなどの二次構造をつなぐ部位の構造を示す。
国際研究グループ
理化学研究所
脳神経研究センター タンパク質構造疾患研究チーム
チームリーダー 田中 元雅(たなか もとまさ)
研修生・大学院生リサーチ・アソシエイト(研究当時) 志田俊信(しだとしのぶ)
計算科学研究センター 粒子系生物物理研究チーム
チームリーダー 杉田 有治(すぎた ゆうじ)
東北医科薬科大学薬学部
教授 山口 芳樹(やまぐち よしき)
岐阜大学 連合創薬医療情報研究科
教授 桑田 一夫(くわた かずお)
長浜バイオ大学 バイオサイエンス学部
准教授 依田 隆夫(よだ たかお)
米国ミシガン州立大学 生化学分子生物学部
教授 マイケル・ファイグ(Michal Feig)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「アミロイドの生成・脱凝集機構の新たなパラダイム創成(研究代表者:田中元雅)」、厚生労働省難治性疾患克服研究事業「プリオン病及び遅発性ウイルス感染症の分子病態解明・治療法開発に関する研究班(研究代表者:山田正仁)」、武田科学振興財団などによる支援を受けて行われました。
原論文情報
Toshinobu Shida, Yuji O. Kamatari#, Takao Yoda#, Yoshiki Yamaguchi, Michael Feig, Yumiko Ohhashi, Yuji Sugita, Kazuo Kuwata and Motomasa Tanaka , “IShort disordered protein segment regulates cross-species transmission of a yeast prion”, Nature Chemical Biology, 10.1038/s41589-020-0516-y
発表者
理化学研究所
脳神経科学研究センター タンパク質構造疾患研究チーム
チームリーダー 田中 元雅(たなか もとまさ)
研修生・大学院生リサーチ・アソシエイト(研究当時) 志田 俊信(しだ としのぶ)
報道担当
理化学研究所 広報室 報道担当


