2025-02-27 東京大学
研究成果のポイント
- 抗体を産生するプラズマ細胞※1はリンパ組織から骨髄に移動して長期生存する
- しかしどのようなプラズマ細胞が骨髄へ移動できるのかは不明であった
- 本研究ではリンパ組織から骨髄へ移動するプラズマ細胞はインテグリンβ7※2を発現することを発見
- また転写因子KLF2※3の発現が骨髄移動性プラズマ細胞の誕生に必要であることを発見
- プラズマ細胞を骨髄へ効率よく移動させるワクチンの開発に期待
概要
大阪大学感染症総合教育研究拠点(CiDER)生体応答学チームの伊勢 渉教授、免疫学フロンティア研究センター(IFReC)の小池 拓矢招へい研究員(研究当時、現:東京大学国際高等研究所新世代感染症センター 特任助教)、黒崎 知博招へい教授(理化学研究所生命医科学研究センター チームリーダー)らの研究グループは、リンパ組織で誕生した抗体産生細胞(プラズマ細胞)の中から、長期生存の場である骨髄へ移動する細胞を発見しました。
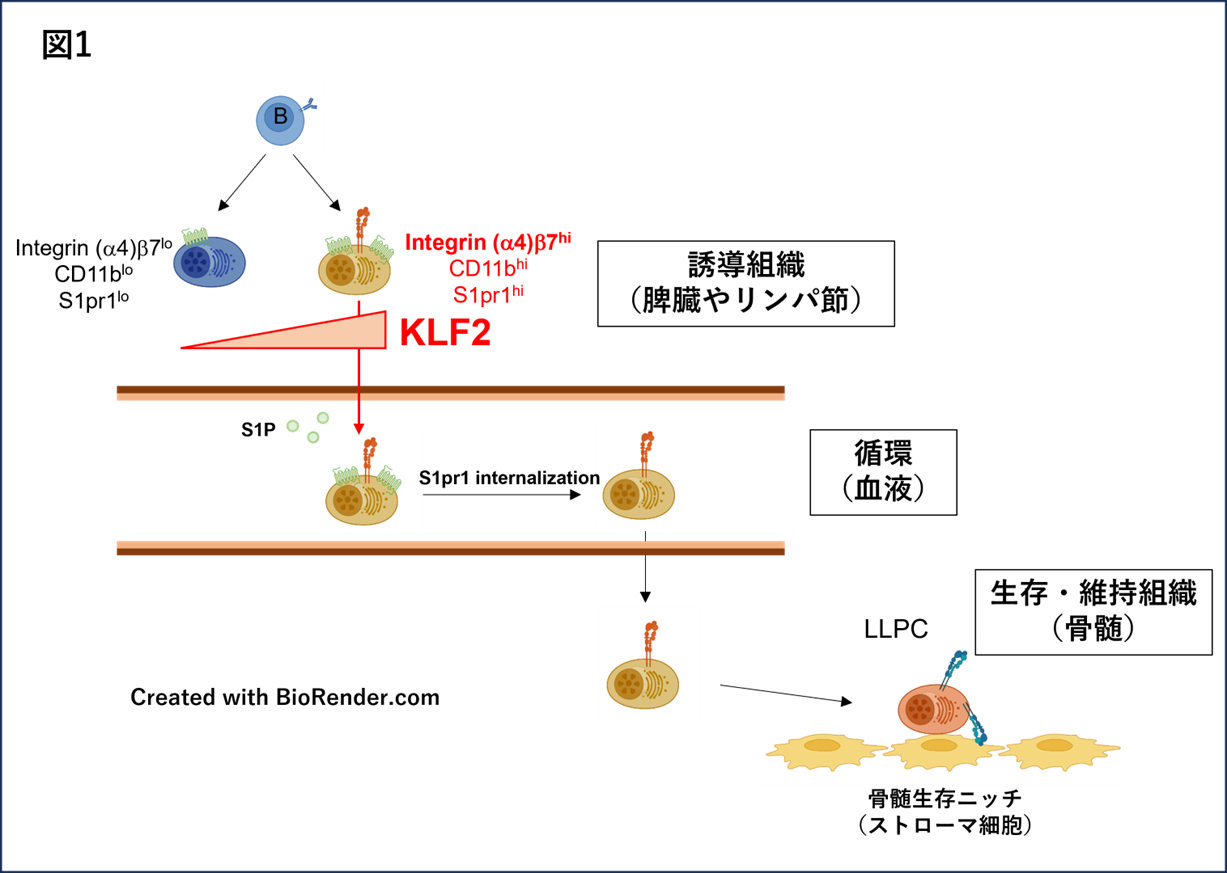
ウイルス感染防御に必須の働きをする中和抗体は、プラズマ細胞によって産生されます。プラズマ細胞は基本的に短命な細胞です。ほとんどが誕生から数日内にリンパ組織内で死滅してしまう一方で、一部がリンパ組織を離れて骨髄に移動し、長期生存することがわかっていました。しかしどのようなプラズマ細胞が骨髄へ移動する能力を持つのかについては明らかにされていませんでした。本研究では、リンパ組織で誕生したプラズマ細胞のうち、インテグリンβ7を高発現する細胞が骨髄へ移動することを見出しました。この細胞は転写因子KLF2によって誘導され、持続的な抗体応答とウイルス感染防御に必要不可欠であることがわかりました。
本研究で得られた結果は、プラズマ細胞の運命(骨髄へ移動し長期生存するかどうか)は誕生直後のKLF2発現レベルによって決定されることを示しています(図1)。本研究成果により、インテグリンβ7/KLF2発現プラズマ細胞の効率的な誘導を狙った新しいワクチン開発が期待できます。
本研究成果は、米国科学誌「Journal of Experimental Medicine」オンライン版に2025年2月21日(日本時間)に掲載されました。
研究の背景
ワクチンで誘導される中和抗体は、ウイルス感染防御に必須の働きをします。ワクチンの持続効果は、中和抗体を産生するプラズマ細胞の寿命に依存していると考えられています。リンパ組織で誕生したプラズマ細胞は骨髄に移動して長期生存することが知られていました。しかしリンパ組織で誕生したプラズマ細胞の全てが等しく骨髄へ移動する能力を持つのか、一部のプラズマ細胞が選択的に骨髄へ移動するのかについては明らかにされていませんでした。
本研究の成果
研究グループは、マウスにタンパク質を免疫して誘導されるプラズマ細胞のうち、インテグリンβ7を発現するプラズマ細胞が優先的にリンパ組織から血液に流出し、最終的に骨髄に移動することを見出しました。この骨髄移動能を持つインテグリンβ7発現プラズマ細胞の誘導には転写因子KLF2が必要でした。またKLF2がGタンパク質共役受容体であるS1pr1の発現を誘導することで、リンパ組織から血液への流出が行われることも判明しました。さらに胚中心B細胞特異的KLF2欠損マウスでは、インフルエンザワクチンによって誘導される特異的抗体応答が持続せず、インフルエンザウイルス感染から防御されないことも明らかになりました。つまり転写因子KLF2依存的にプラズマ細胞が骨髄へ移動することが、抗体応答の持続性と感染防御に重要であることが示されました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究により、中和抗体を産生するプラズマ細胞が長期生存の場である骨髄へ移動するメカニズムが初めて明らかとなりました。本研究の成果は、プラズマ細胞の効率的な骨髄移動を狙ったワクチンの開発につながる可能性があります。
発表者
Wataru Ise1,2,8,†,*,Takuya Koike1,2,7,9,†, Nozomi Shimada1,2, Hiromi Yamamoto2, Yuki Tai2, Taiichiro Shirai3, Ryoji Kawakami4, Mana Kuwabara1, Chie Kawai2, Kyoko Shida2, Takeshi Inoue2,9, Nozomi Hojo5, Kenji Ichiyama4, Shimon Sakaguchi4,10, Katsuyuki Shiroguchi5, Kazuhiro Suzuki3, and Tomohiro Kurosaki2,6,7,*
(†筆頭著者)(*責任著者)
【所属】
1大阪大学感染症総合教育研究拠点 感染症・生体防御研究部門 生体応答学チーム
2大阪大学免疫学フロンティア研究センター 分化制御研究室
3大阪大学免疫学フロンティア研究センター 免疫応答動態学研究室
4大阪大学免疫学フロンティア研究センター 実験免疫学研究室
5理化学研究所生命機能科学研究センター 細胞システム動態予測研究チーム
6大阪大学感染症総合教育研究拠点
7理化学研究所生命医科学研究センター 分化制御研究チーム
8大阪大学ワクチン開発拠点 先端モダリティ・ドラッグデリバリーシステム研究センター
9東京大学国際高等研究所新世代感染症センター(UTOPIA)分子免疫システム分野
10京都大学医生物学研究所生体再建学分野
研究助成
本研究は日本財団、大塚製薬、日本学術振興会科学研究費助成事業、日本医療研究開発機構(AMED)先進的研究開発戦略センター(SCARDA)「ワクチン開発のための世界トップレベル研究開発拠点群 東京フラッグシップキャンパス、大阪府シナジーキャンパス(大阪大学ワクチン開発拠点)」、武田科学振興財団、上原記念生命科学財団、内藤記念科学振興財団、先進医薬研究振興財団、第一三共生命科学研究振興財団の支援を受けて行われました。
用語解説
※1 プラズマ細胞
B細胞が分化して、大量の抗体を分泌するようになった細胞。大部分のプラズマ細胞はリンパ組織内で2, 3日で死滅するが、一部は長期に渡って生存する。ヒトの腸管組織や骨髄において数十年に渡って生存したプラズマ細胞の存在が報告されている。
※2 インテグリンβ7
インテグリンβ鎖ファミリーに属するI型膜タンパク質。インテグリンは、大きなファミリーを構成する細胞表面糖タンパク質受容体であり、特異的なリガンドにヘテロ二量体として結合することにより、細胞の接着、シグナル伝達、増殖、移動で重要な役割を果たす。インテグリンβ7は、主にα4インテグリンを結合して、α4/β7ヘテロ二量体を形成し、MADCAM1、VCAM、フィブロネクチンと相互作用する。
※3 転写因子KLF2
転写因子は遺伝子の発現を制御するタンパク質の総称。ゲノムDNA上の特定の配列を認識し、そこに直接結合することで、近傍遺伝子の発現を誘導あるいは抑制する。KLF2(Kruppel-like transcription factor 2)は細胞の移動や成熟、造血の恒常性維持などに関わる転写因子。これまで胸腺細胞やT細胞の移動制御、成熟T細胞の生存制御に関わることが知られていた。
<研究に関する問い合わせ先>
伊勢 渉(いせ わたる)
大阪大学感染症総合教育研究拠点 感染症・生体防御研究部門 生体応答学チーム 教授
黒﨑 知博 (くろさき ともひろ)
大阪大学免疫学フロンティア研究センター 招へい教授
理化学研究所 生命医科学研究センター 分化制御研究チーム チームリーダー
論文情報
Wataru Ise, Takuya Koike, Nozomi Shimada, Hiromi Yamamoto, Yuki Tai, Taiichiro Shirai, Ryoji Kawakami, Mana Kuwabara, Chie Kawai, Kyoko Shida, Takeshi Inoue, Nozomi Hojo, Kenji Ichiyama, Shimon Sakaguchi, Katsuyuki Shiroguchi, Kazuhiro Suzuki, Tomohiro Kurosaki, “KLF2 expression in IgG plasma cells at their induction site regulates the migration program,” Journal of Experimental Medicine: 2025年2月21日, doi:10.1084/jem.20241019.
論文へのリンク (掲載誌)
お問い合わせ先
〈研究に関する問合せ〉
伊勢 渉(いせ わたる)
大阪大学感染症総合教育研究拠点 感染症・生体防御研究部門 生体応答学チーム 教授
黒﨑 知博 (くろさき ともひろ)
大阪大学免疫学フロンティア研究センター 招へい教授
理化学研究所 生命医科学研究センター 分化制御研究チーム チームリーダー
〈報道に関する問合せ〉
坂野上 淳(さかのうえ じゅん)
大阪大学免疫学フロンティア研究センター 企画室
特任教授(常勤)
東京大学国際高等研究所 新世代感染症センター(広報)