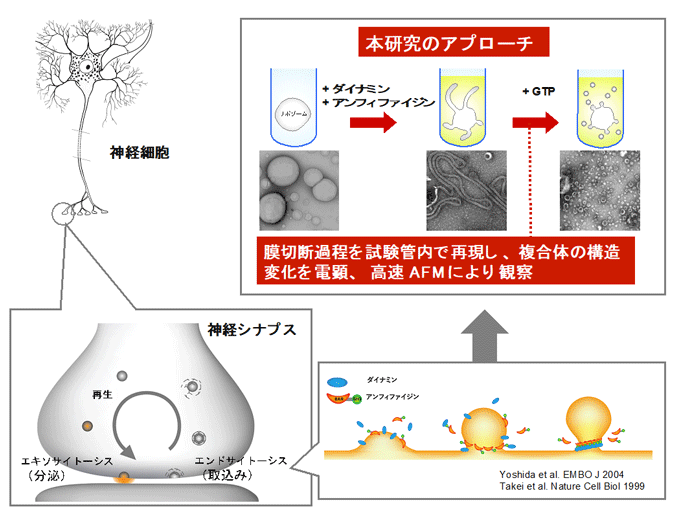
ダイナミン-アンフィファイジン複合体による膜切断を直接可視化
2018-01-26 岡山大学 科学技術振興機構(JST)
ポイント
- “エンドサイトーシス”は細胞が物質を外から取り込む重要なプロセスで、基本的に全ての細胞に存在する。しかし、エンドサイトーシスにおける膜切断分子がどのような仕組みで働くのか、これまで不明であった。
- 今回、高速AFMと電子顕微鏡を用いた観察により、膜切断過程における膜切断分子(ダイナミン-アンフィファイジン複合体)の動的な構造変化を直接可視化することに世界に先駆けて成功した。
- ダイナミンやアンフィファイジンが異常となる神経や筋肉の難病が知られており、それらの疾患の発症メカニズムの解明につながる。
エンドサイトーシスでは、細胞膜の限られた領域が細胞質側に陥入、切断されて小胞が形成されます。その際に、GTPアーゼ注3)であるダイナミンとBARドメイン注4)を持つたんぱく質アンフィファイジンが、膜の切断部位にらせん状の複合体を形成し、GTPの加水分解に伴う構造変化を起こして膜を切断します。
X線結晶構造解析やクライオ電子顕微鏡解析を用いた先行研究で、ダイナミンやアンフィファイジンの立体構造はすでに明らかになっていました。しかし、膜切断過程で起こるダイナミン-アンフィファイジン複合体のダイナミックな構造変化や、アンフィファイジンによるダイナミンの機能調節機構については、これまでほとんど解明されていませんでした。
本研究の成果は、エンドサイトーシスにおける膜リモデリング機構の解明だけでなく、ダイナミンやアンフィファイジンの機能異常が原因で起こる、神経や筋肉の難病の発症メカニズム解明にもつながることが期待されます。
本研究の成果は2018年1月23日(日本時間)、国際科学誌「eLife」に掲載されました。
エンドサイトーシスは、細胞が細胞外物質を細胞内に取り込む経路で、神経伝達、シグナル伝達、細胞接着、細胞運動など、さまざまな生命現象において重要な役目を果たします。エンドサイトーシスでは、細胞膜の限られた領域が陥入・切断されることによって小胞が形成されます。エンドサイトーシスのプロセスには数多くのたんぱく質が関与していますが、その中でもダイナミンは膜の切断過程で非常に重要な役割を果たします。ダイナミンはGTPアーゼで、膜の切断部位にらせん状の複合体を形成し、GTPの加水分解に伴う構造変化を起こして膜を切断します(図1)。ダイナミンの立体構造データに基づき、これまでにさまざまな膜切断モデルが提唱されていましたが、実際のメカニズムは明らかになっていませんでした。また、ダイナミンはアンフィファイジンなどのBARドメインを持つたんぱく質と相互作用し、両者の協働によってエンドサイトーシスが進行しますが、アンフィファイジンによるダイナミンの機能調節の仕組みについても、これまで明らかになっていませんでした。
岡山大学の竹田助教と竹居教授、金沢大学の安藤特任教授、名古屋大学の内橋教授らの共同研究チームは、エンドサイトーシスにおいて、ダイナミン-アンフィファイジン複合体が膜を切断するメカニズムを解明しました。
研究チームは、精製したダイナミン-アンフィファイジン複合体とリポソームを用いて膜切断過程を試験管内で再現し(図1)、GTPの加水分解に共役した構造変化や分子動態を、生命現象を直接可視化できる技術である高速AFMを用いて詳細に解析しました。その結果、ダイナミン-アンフィファイジンのらせん状複合体は、GTPの加水分解に伴って脂質膜上でクラスター化し(図2)、その両端にあるたんぱく質が存在しない膜部位で膜の切断が起こることが明らかになりました(図3)。さらに、アンフィファイジンはクラスターの数や大きさを調節し、エンドサイトーシスにおける小胞形成を促進する機能を持つことが初めて明らかになりました(図4)。以上の結果をもとに、ダイナミン-アンフィファイジンによる新規の膜切断モデルを提唱しました(図5)。
ダイナミンの異常は、年齢依存性てんかん性脳症注5)、シャルコー・マリー・トゥース病注6)、先天性ミオパチー注7)など、神経や筋肉におけるさまざまな先天性疾患の原因になっています。またアンフィファイジンの異常も先天性ミオパチーの原因であり、アンフィファイジンが神経の自己免疫疾患(スティッフパーソン症候群)注8)の自己抗原であることも知られています。
本研究成果は、エンドサイトーシスにおける膜切断メカニズムの解明だけでなく、ダイナミンやアンフィファイジンが関与するさまざまな疾患の発症機序を、分子レベルで解明することにつながることが期待されます。
![]()
図1
![]()
図2
![]()
図3
![]()
図4
![]()
図5
-
- タイトル:
Dynamic clustering of dynamin-amphiphysin helices regulates membrane constriction and fission coupled with GTP hydrolysis - 著者名:
Tetsuya Takeda, Toshiya Kozai, Huiran Yang, Daiki Ishikuro, Kaho Seyama, Yusuke Kumagai, Tadashi Abe, Hiroshi Yamada, Takayuki Uchihashi, Toshio Ando, Kohji Takei - doi:
10.7554/eLife.30246
- タイトル:
- 注1)ダイナミン-アンフィファイジン複合体
- GTPアーゼであるダイナミンと、BARドメインを持つアンフィファイジンによって形成されるたんぱく質複合体。エンドサイトーシスにおける膜の陥入や切断に中心的な機能を持つ。
- 注2)高速AFM(高速原子間力顕微鏡)
- カンチレバーと呼ばれる鋭い探針で試料表面をなぞることで、試料表面の凹凸を可視化する顕微鏡。金沢大学の安藤 敏夫 特任教授の研究グループによって高速化および生体試料の観察が実現し、溶液中で生体分子の反応や構造変化を高分解能かつリアルタイムに観察することが可能になった。
- 注3)GTPアーゼ
- グアノシン三リン酸(GTP)と結合し加水分解する酵素あるいはたんぱく質。GTPの加水分解のエネルギーを構造変化に使い、シグナル伝達、たんぱく質の生合成と輸送、細胞骨格の調節、細胞分裂・分化の調節、細胞内小胞輸送など、いろいろな細胞の調節を行う。
- 注4)BAR(Bin/Amphiphysin/Rvs)ドメイン
- 細胞膜に結合し、膜の変形および曲率を感知するたんぱく質の機能ドメイン。三日月型の2量体を形成し、負に帯電している細胞膜と静電的に相互作用する。エンドサイトーシスにおける膜の陥入や、細胞質分裂における膜の動態制御など多様な細胞機能を担う。多くのBARドメインたんぱく質はSH3ドメインを持ち、プロリンリッチ(PR)ドメインを持つたんぱく質と相互作用する。例えば、アンフィファイジンもSH3ドメインを介して、ダイナミンのPRドメインに直接結合する。
- 注5)年齢依存性てんかん性脳症
- 新生児期から幼児期にかけて年齢依存的に特徴的なてんかん発作を発症する、難治性の疾患。
- 注6)シャルコー・マリー・トゥース病
- 末梢神経障害による四肢遠位部優位の筋力低下や感覚低下などの症状を示す末梢神経の難病。
- 注7)先天性ミオパチー
- 生まれながらに筋組織の形態に異常があり、筋力や筋緊張の低下、呼吸障害、嚥下障害などを伴う、先天性の難病。
- 注8)スティッフパーソン症候群
- 筋肉を弛緩させるための神経系統がうまく機能せず、体の硬直や筋けいれんを起こす、非常に稀な進行性の自己免疫疾患。
<研究に関すること>
竹田 哲也(タケダ テツヤ)
岡山大学 大学院医歯薬学総合研究科 助教
竹居 孝二(タケイ コウジ)
岡山大学 大学院医歯薬学総合研究科 教授
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
<報道担当>
岡山大学 総務企画部広報 情報戦略室
科学技術振興機構 広報課