2018-02-09 公立大学法人横浜市立大学,国立研究開発法人日本医療研究開発機構
横浜市立大学 学術院医学群 臓器再生医学 谷口英樹主任教授、同大学 先端医科学研究センター 武部貴則教授(東京医科歯科大学 統合研究機構 教授)らの研究グループは、肝臓や腸などの作製に使用可能な内胚葉前駆細胞(PGEC)の誘導に成功しました。今回ヒトiPS細胞*1から作製したPGECは、CDX2と呼ばれる初期発生で生じる後方内胚葉のマーカーを有した細胞集団で、iPS細胞と比較して安定して肝細胞や腸細胞を分化誘導することが可能なだけでなく、性質を維持したまま複数回に渡る増幅が可能であることが明らかとなりました。また、PGECから作製したミニ肝臓を、亜急性肝不全免疫不全モデルに移植したところ、生存率の改善を示しました。今後、このPGECは、内胚葉器官を対象としたヒト発生生物学研究の強力なツールとなると考えられます。将来的に、肝臓や腸などを対象とした創薬研究や再生医療研究における有用性・安全性が確立されれば、増幅・凍結保存の可能な新たな細胞ソースとしての活用も期待されます。
研究成果のポイント
- ヒトiPS細胞からCDX2陽性後方内胚葉前駆細胞*2の誘導に成功
- この細胞は、性質を維持した継代培養と肝臓や腸のオルガノイド*3の安定的な作製が可能
- この細胞由来肝オルガノイドの移植で亜急性肝不全モデルマウスの生存率を改善
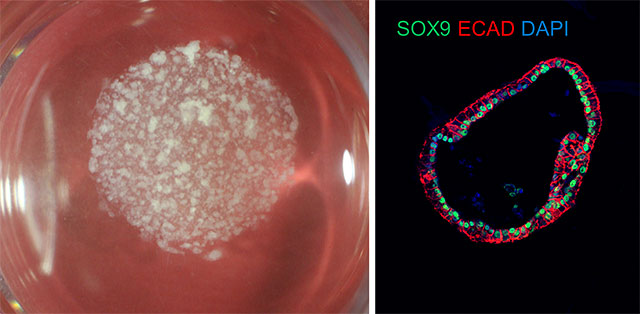
図1.増幅したPGECからの腸オルガノイド誘導
左:肉眼観察像により、大量の腸オルガノイドが形成されていることを確認。
右:蛍光観察像により、腸上皮細胞であることを発現することを示す。SOX9(緑):腸マーカー/ECAD(赤):上皮マーカー/DAPI(青):細胞核マーカー
研究の背景
肝臓や膵臓、腸などの組織の発生学的な起源は、内胚葉と呼ばれる細胞集団であることが知られています。この内胚葉細胞は、胎児の段階では極めて少数の細胞集団ですが、出生後は全長数メートルにもおよぶ消化管や肝臓、膵臓などを含む大量の子孫細胞を生み出すことから、元来、高い細胞増幅活性を有しているものと考えられます。しかしながら、試験管内において内胚葉細胞を誘導し、かつ、それらを増殖・分化誘導することはいまだ困難でした。
本研究では、内胚葉細胞の発生で重要性が示唆されているタンパク質等を組み合わせることにより、ヒトiPS細胞から後方(肛門側)マーカーのCDX2を発現する後方内胚葉前駆細胞(Posterior Gut Endoderm Cells, PGEC)の誘導を試み、さらに、PGECの増幅培養系を確立することにより、さまざまな臓器のオルガノイドを形成可能か検証しました。
研究の内容
本研究では、フィーダーフリーで培養したiPS細胞について数々の培養条件を探索した結果、以下の4段階を経て、CDX2陽性PGECが誘導できることを見出しました。
- SFD培地+Rock Inhibitor
- SFD培地+Activin A+Wnt3a
- RPMI培地+SFD、BMP4+bFGF+VEGF+Activin A
- SFD培地+BMP4+bFGF+VEGF+Activin A
このような複雑なステップを経て誘導されたPGECは、さまざまな後方内胚葉細胞マーカーを発現していることに加えて、分化能力を保ったまま繰り返し増幅可能であること、増幅後も正常核型を示すこと、凍結保存が可能であること、などの特徴を有していました(図2)。
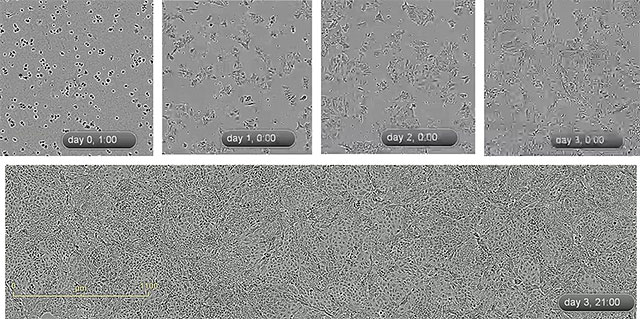
図2.誘導したPGECの増幅過程のタイムラプス動画から抜粋
次に、継代後のPGECの分化能力の確認を目的として、腸組織の誘導を行った結果、単一ないし複数個のPGECからでも、E-カドヘリンやSOX9などが陽性の腸オルガノイドを作製することが可能でした(図1)。さらに、肝細胞分化誘導が可能であるか検討したところ、形態学的解析の結果、継代を繰り返した後も、再現性良く肝細胞を誘導できることが明らかとなりました(図3)。興味深いことに、遺伝子発現解析および、ELISA*4によるタンパク質分泌機能解析の結果、継代を繰り返したのちのPGEC由来肝細胞機能は、iPS細胞から誘導した肝細胞と比較して、有意に高い血漿タンパク産生機能を有していることが明らかとなり、さらにヒトPGECは、著者らが2013年のNature誌(Takebe T, et al. Nature 499(7459):481-4, 2013)に発表した手法を用いて、肝オルガノイド(ミニ肝臓)を大量に形成できることも示されました(図4)。このPGEC由来肝オルガノイドを亜急性肝不全モデルマウスに移植した結果、生存率を改善することが示されました。

図3.増幅したPGECからの肝細胞様細胞の誘導
肝細胞の形態を示す細胞が視野一面に均一に存在している。
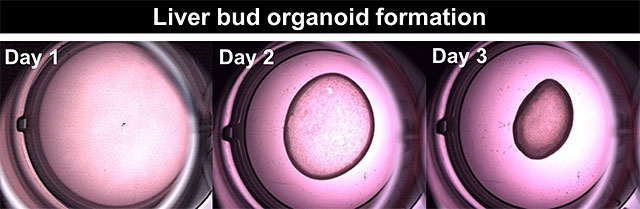
図4.増幅したPGECからの肝オルガノイドの誘導
今後の展開
本研究により、ヒトiPS細胞と、分化した機能細胞の中間段階に位置する、CDX2陽性の後方腸内胚葉細胞(Posterior Gut Endoderm Cells:PGECs)の誘導が可能となりました。また、PGECは、凍結保存や増幅、肝臓や腸のオルガノイド誘導などが可能といった特徴を有していることが示されました。一方、従来の発生生物学の知見からは、CDX2陽性の後方内胚葉細胞の分化能力は、通常、大腸などの肛門側の組織にある程度限定されることが知られており、肝臓や膵臓などのより口側の組織を生み出すことは一般的に考えにくく、今回の研究において、なぜ試験管内で誘導したPGECが、肝臓などの口側に位置する器官の細胞を生み出せるのかには疑問が残っています。今後、モデル生物におけるin vivoの研究、および、ヒトPGECを用いたin vitroの研究を組み合わせることにより、CDX2陽性の予期せぬ肝分化能力に関してのメカニズムを解明していくことが必要です。
近年、iPS/ES細胞などの多能性幹細胞より誘導した分化細胞や組織を利用して、新たな医薬品を開発するための創薬スクリーニングや、失われた臓器の機能を補う再生医療を実現化することが注目されています。ヒトPGECを用いることにより、ヒトiPS細胞から直接分化組織を得る方法と比較して、分化誘導期間が短縮されること、凍結保存ストックを作製できること、内胚葉組織の誘導のバラつきが最小化されることなどが期待され、将来的にPGECの再生医療における有用性・安全性が確認されれば、安定的かつ大量の組織を得るための重要な技術基盤となることが期待されます。
用語説明
- *1 iPS細胞:
- 体細胞に特定因子を導入することにより樹立される、ES細胞に類似した多能性幹細胞。2006年に山中伸弥教授の研究グループにより世界で初めてマウス体細胞を用いて樹立成功が報告された。2007年にヒトiPS細胞樹立成功が発表されている。
- *2 後方腸内胚葉細胞(PGEC):
- 胎児期に生じる未熟な細胞のことで、小腸や大腸など、さまざまな腹部の内臓を生み出す能力をもった前駆細胞。
- *3 オルガノイド:
- 生体内で存在する器官に類似した培養環境で生み出す組織構造体のこと。近年盛んに研究が進んでいる技術領域であり、著者らも2013年、2017年に肝オルガノイド(ミニ肝臓)が作製可能であることをNature誌(Nature 499(7459):481-4, 2013 doi:10.1038/nature12271.)、Cell Reports誌(Cell Reports 21, 2661–2670, 2017 https://doi.org/10.1016/j.celrep.2017.11.005)に報告している。
- *4 ELISA(Enzyme Linked Immunosolvent Assay):
- 抗原抗体反応を利用して微量生体物質を定量する方法。測定はマイクロプレート上で行われる。
※本研究は、『Stem Cell Reports』に掲載されます。(米国東部時間2月8日正午付:日本時間2月9日午前2時付オンライン)
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム」(「iPS細胞を用いた代謝性臓器の創出技術開発拠点」研究代表者:谷口英樹) 、国立研究開発法人科学技術振興機構(JST)「戦略的創造研究推進事業」の一環として行われました。
掲載論文
Human iPSC Derived Posterior Gut Progenitors Are Expandable And Capable Of Forming Gut And Liver Organoids
Ran-Ran Zhang, Masaru Koido, Tomomi Tadokoro, Rie Ouchi, Tatsuya Matsuno, Yasuharu Ueno, Keisuke Sekine, Takanori Takebe, and Hideki Taniguchi
Stem Cell Reports, February 8, 2018
お問い合わせ先
本資料の内容に関するお問い合わせ
公立大学法人横浜市立大学 学術院医学群 臓器再生医学
武部 貴則、谷口 英樹
取材対応窓口、詳細の資料請求など
公立大学法人横浜市立大学 研究企画・産学連携推進課長
渡邊 誠
AMEDの事業について
国立研究開発法人 日本医療研究開発機構 戦略推進部 再生医療研究課