2019-09-13 理化学研究所
理化学研究所(理研)生命医科学研究センター応用ゲノム解析技術研究チームの安岡有理研究員、八木研客員主管研究員、岡﨑康司チームリーダーらの共同研究チーム※は、細胞の初期化(リプログラミング)[1]に働く「GLIS1遺伝子[2]」が脊椎動物の多様化と繁栄をもたらした全ゲノム重複[3]によって生み出されたものであることを発見しました。
本研究成果は、細胞初期化の基本メカニズムの解明や再生医療分野への応用に向けた、今後の研究の方向性を照らし出すものと期待できます。
今回、共同研究チームは、安全かつ高効率なiPS細胞[1]の作製を可能にする初期化因子GLIS1に注目し、いつどのようにしてGLIS1遺伝子が初期化因子としての働きをするようになったのか、その進化の歴史を調べました。その結果、GLISと名の付く遺伝子はほかにGLIS2[2]とGLIS3[2]がありますが、GLIS2は分岐の古い遠い親戚であり、GLIS3が脊椎動物の誕生とともに分岐したGLIS1に近縁な遺伝子であることが明確に示されました。このことは、今後のリプログラミング研究ではGLIS1とGLIS3の違いに注目すべきだということを意味しています。さらに、GLIS1とGLIS3の祖先的な役割(祖先遺伝子GLIS1/3が持っていた従来の機能)が、繊毛[4]を持つ組織の形成・維持であることがより詳細なゲノム比較研究から予想されました。
本研究は、英国の科学雑誌『Molecular Biology and Evolution』オンライン版(9月5日付け)に掲載されました。
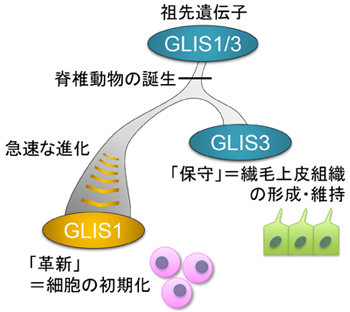
図 脊椎動物におけるGLIS1遺伝子の独自の進化
※共同研究チーム
理化学研究所 生命医科学研究センター 応用ゲノム解析技術研究チーム
研究員 安岡 有理(やすおか ゆうり)
客員研究員 松本 征仁(まつもと まさひと)
客員主管研究員 八木 研(やぎ けん)
チームリーダー 岡﨑 康司(おかざき やすし)
順天堂大学大学院 医学研究科 難病の診断と治療研究センター
客員准教授 松本 征仁(まつもと まさひと)
センター長 岡﨑 康司(おかざき やすし)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究「進化の制約と方向性(領域代表者:倉谷滋)」のうち「ネッタイツメガエル胚発生における転写因子ー標的遺伝子関係の揺らぎ測定(研究代表者:安岡有理)」、同若手研究「造礁サンゴの初期石灰化過程に関わる遺伝子の機能解析(研究代表者:安岡有理)」、同基盤研究C「細胞運動非依存的な脊索の自律的形態形成メカニズムの解明(研究代表者:安岡有理)」、および同若手研究B「脊椎動物におけるBrachyuryの遺伝子重複がもつ進化発生学的意義の解明(研究代表者:安岡有理)」による支援を受けて行われました。
背景
iPS細胞に代表される細胞の初期化(リプログラミング)技術は、患者由来の細胞から任意の細胞・組織を作り出すことを目指す再生医療の発展には欠かせない技術です。しかしその技術の発展に比べ、どのような仕組みで細胞が初期化されているのかは、いまだ不明な点が多く残っています。 iPS細胞は、山中4因子と呼ばれる四つの転写因子[5](OCT3/4、SOX2、KLF4、c-MYC)を体細胞に導入することで初めて樹立されましたが、c-MYCは腫瘍形成のリスクが高いため、代替因子の探索がその後盛んに行われました。その一つが「GLIS1遺伝子」です。GLIS1は転写因子として働き、c-MYCを除く3因子(OCT3/4、SOX2、KLF4)とともに体細胞に導入すると、安全かつ高効率にiPS細胞を作製できました注1)。さらに、GLIS1は初期化が不完全な細胞の増殖を抑え、完全に初期化された細胞のみを増殖させる働きもあったことから、注目の因子として期待を集め、すでにGLIS1を用いて樹立されたiPS細胞が臨床応用されています注2)。
GLIS1のもう一つ重要な点は、マウスの未授精卵および受精卵1細胞期で高度に発現しているということです。山中伸弥博士とともにノーベル賞を受賞したジョン・ガードン博士がかつて示したように、卵に細胞核を移植すると短時間で効率よく初期化が起こります。GLIS1はこの卵の持つ高い初期化能力の一部を担っていると予想されます。したがって、GLIS1の働き方を調べれば、細胞初期化の基本的なメカニズムを解明することにつながると期待されています。
注1) Momoko Maekawa, et al. “Direct reprogramming of somatic cells is promoted by maternal transcription factor Glis1.” Nature 2011, 474, 225–229
注2) 2017年3月16日プレスリリース「加齢黄斑変性に対する自己iPS細胞由来網膜色素上皮シート移植」
研究手法と成果
共同研究チームは、GLIS1遺伝子がいつどのように初期化因子としての働きをするようになったのか、遺伝子の進化に焦点を当てて研究を行いました。
GLIS1遺伝子の進化の歴史を探るため、さまざまな動物のゲノム情報[6]をもとに遺伝子系統樹解析[7]を行いました。その結果、脊椎動物の誕生時に起こった全ゲノム重複によって、GLIS1遺伝子はGLIS3というよく似た遺伝子と分岐したことが分かりました(図1)。つまり、GLIS1とGLIS3の祖先遺伝子をGLIS1/3とすると、無脊椎動物は基本的にGLIS1/3を一つだけ持つのに対し、脊椎動物はGLIS1とGLIS3の二つの遺伝子を持つことになります。また、類似して存在するGLIS2およびGLI[2]という遺伝子に関しては、脊椎動物が生まれるもっと以前に分岐したものであり、今回の研究によってGLIS1の起源と最も関係が深いのはGLIS3だということが明確に示されました(図1)。
次に、GLIS1とGLIS3の進化速度の違いを調べるため、タンパク質の構造(アミノ酸配列)を比較したところ、GLIS3が祖先遺伝子産物GLIS1/3に由来するアミノ酸配列を多く保持しているのに対し、GLIS1はそのほとんどを失って進化のスピードを速めていることが分かりました。このことは、GLIS3が祖先遺伝子から受け継いだ役割を「保守」する一方で、GLIS1が新たな役割を担うべく急速に進化したことを示唆しています。この急速な進化が、GLIS1の「革新」的機能(=リプログラミング活性)と深く関わっていると考えられます(図1)。
さらに、脊椎動物のGLIS1、GLIS3および無脊椎動物のGLIS1/3について、卵細胞で母性因子[8]として発現しているのかを調べました。その結果、すでに報告のあったマウスに加え、ウシ・ニワトリ・カエルでもGLIS1が母性因子として発現していることが分かりました。一方、魚類や無脊椎動物のGLIS1/3遺伝子群では、卵細胞でのGLIS1の母性因子としての発現がほとんど見られませんでした。したがって、GLIS1は脊椎動物もしくは四肢動物の系統で母性因子としての発現を獲得したと考えられます。GLIS1の卵での発現は、初期化因子としての働きと深く関わっている可能性があり、この結果も脊椎動物が独自にGLIS1を初期化因子として進化させたことを示唆しています。
最後に、GLIS1/3遺伝子群の祖先的な役割を調べるため、染色体上の遺伝子の並び方に注目しました。すると、GLIS1/3は、RFX3、NDC1、HSPB11、LRRC42という四つの遺伝子と染色体上の非常に近い位置にかたまって存在することが分かりました。このような構造を「遺伝子クラスター」と呼びますが、この遺伝子クラスターは無脊椎動物のタコから脊椎動物のヒトに至る多くの動物に共通して存在することも分かりました。この五種類の遺伝子産物の働きがどれも繊毛に関わることから、共同研究チームは「繊毛遺伝子クラスター」と名付けました(図2)。
これまで、似通ったタンパク質構造を持つ遺伝子群がクラスターを形成する例(HOX遺伝子クラスター[9]やβグロビン遺伝子クラスター[10]など)は数多く報告されてきましたが注3,4)、今回のような生理的な機能で関わり合う遺伝子がクラスターを形成するという報告例は珍しく、進化生物学的に非常に大きな発見であると考えられます。実際、「保守」的な役割を担うであろうGLIS3は、腎臓や膵臓(すいぞう)などの臓器において、繊毛上皮組織の発生・分化に不可欠な役割を持つことが知られており、この繊毛遺伝子クラスターはGLIS1/3の祖先的な役割が繊毛を持つ細胞の形成・維持であることを意味しています。
注3) Peter W. H. Holland, “Evolution of homeobox genes”, WIREs DEVELOPMENTAL BIOLOGY, 2013 Jan-Feb;2(1):31-45 注4) Ross C. Hardison, “Evolution of Hemoglobin and Its Genes”, Cold Spring Harb Perspect Med. 2012 Dec; 2(12): a011627.
今後の期待
膨大な遺伝子情報が蓄積している昨今、どこに焦点を当てて研究を進めていくべきかを判断するのがますます難しくなってきています。遺伝子の由来を知ることは、適切な比較解析対象を設定する上で非常に重要な視点であることを、本研究は明確にしました。例えば、マウス・カエル・メダカのGLIS1およびGLIS3の細胞初期化能力を比較すれば、マウスGLIS1タンパク質のどの部分が初期化の働きを担っているのかをあぶり出すことができます。そこから、細胞初期化の基本メカニズムの解明につながると期待できます(図3)。
本研究で新たに発見された「繊毛遺伝子クラスター」は、脳・肺・膵臓・腎臓など、さまざまな臓器に存在する繊毛を持った細胞の働きにとって重要な遺伝子群であることが予想されます。GLIS1/3遺伝子と、他のクラスター遺伝子との関わりを調べていくことで、繊毛の異常が原因となる疾患の研究に役立つと期待できます。
進化学と医学は一見相異なる研究分野のように思えるかもしれませんが、進化の歴史から光を当てることで、生命医科学研究の今後の方向性が照らし出される可能性は大いにあります。このような学際的な研究を今後も継続することは、将来の医学の発展にも寄与する重要な試みになります。
原論文情報
Yuuri Yasuoka, Masahito Matsumoto, Ken Yagi, and Yasushi Okazaki, “Evolutionary History of GLIS genes illuminates their Roles in Cell Reprogramming and Ciliogenesis”, Molecular Biology and Evolution, 10.1093/molbev/msz205
発表者
理化学研究所
生命医科学研究センター 応用ゲノム解析技術研究チーム
研究員 安岡 有理(やすおか ゆうり)
客員主管研究員 八木 研(やぎ けん)
チームリーダー 岡﨑 康司(おかざき やすし)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 初期化(リプログラミング)、iPS細胞
- 多細胞生物の体細胞は、受精卵から成熟する過程において特定の遺伝子のみを発現するようにプログラムされていき、やがて異なる種類の細胞へは変化できないようになる。このような体細胞を、元のいろいろな細胞へと分化可能な状態(分化多能性)へ戻すことを初期化(リプログラミング)と呼ぶ。2012年にノーベル医学生理学賞を受賞したジョン・ガードン博士は、カエルの卵を用いて世界で初めて人工的な初期化に成功した。また、共同受賞者の山中伸弥博士は、特定の遺伝子を導入することで体細胞を初期化することに成功し、iPS細胞(人工多能性幹細胞)を樹立した。
-
- GLIS1遺伝子、GLIS2遺伝子、GLIS3遺伝子、GLI遺伝子
- ジンクフィンガードメインと呼ばれる構造を持つタンパク質(転写因子)をコードする一連の遺伝子群。1980年代末にGLI遺伝子群(GLI1、GLI2、GLI3)が発見され、その後GLI-Similar(GLIに似ている)遺伝子として、GLIS1、GLIS2、GLIS3が2000年代初頭に相次いで発見された。ヒトが持つGLI1、GLI2、GLI3という三つのGLI遺伝子は、脊椎動物共通祖先における2回の全ゲノム重複によって生じたものである。
-
- 全ゲノム重複
- ある生物の系統で全ゲノムが丸ごと倍化する現象。全ての遺伝子のコピー数が倍になり、多くの場合は不要になったコピーが進化の過程で失われていくが、一部の遺伝子ではコピー間の役割分担(subfunctionalization)や、片方のコピーの新規機能獲得(neofunctionalization)が起こることで、遺伝子ネットワークが巧妙かつ複雑になっていくと考えられている。脊椎動物の共通祖先は全ゲノム重複を2回経験しており、コピー数の増えた遺伝子の使い道を変えていくことで、その後の多様化と繁栄につながったと考えられている。
-
- 繊毛
- 細胞の表面に突出している毛のような構造物。水流を作り出す運動性の繊毛と、細胞外からのシグナルを受容する非運動性の繊毛が存在する。生物の発生過程や恒常性維持に重要な役割を持ち、繊毛の機能不全が原因となるヒト疾患(繊毛病)として、内蔵逆位や腎嚢胞などが知られている。
-
- 転写因子
- DNAに直接もしくは間接的に結合し、他の遺伝子がDNAからRNAへと転写されるタイミングや量を調節するタンパク質。
-
- ゲノム情報
- ある生物が持つ全遺伝情報の1セット。ヒトは約30億文字のDNA配列情報を持ち、約2万の遺伝子(タンパク質)がコードされている。遺伝子をコードする領域はわずか2%ほどで、大量の非コード領域を挟んでゲノムDNA上に点在している。
-
- 系統樹解析
- アミノ酸配列やDNA配列、または生物が持つ形態的・生態的特徴に基づいて、生物や遺伝子の進化的な道筋を推定する方法。樹状図を用いて、遺伝子配列や表現型の差異から分岐点やその時期などを推測する。本研究では、生物種の系統樹と遺伝子の系統樹を重ね合わせることで、遺伝子の由来をより正確に推定するウェブツール「ORTHOSCOPE」を解析に用いた。
-
- 母性因子
- 未受精卵にタンパク質あるいはmRNAとして存在し、受精後にゲノムDNAからmRNAの転写が開始されるまでの間の発生初期過程を担う一連の遺伝子産物群。卵に体細胞核を移植したときに起こる初期化現象は、まさに母性因子の働きによるものであり、細胞を初期化する働きを持つものが数多く存在すると考えられている。
-
- HOX遺伝子クラスター
- ホメオボックスと呼ばれるタンパク質構造を持つ転写因子をコードする一連の遺伝子群。多くの動物ではHox1~Hox13が染色体上に一列に並んでおり、体の前後軸に沿って番号順に発現することで、各領域の形作りに重要な役割を担っている。
-
- βグロビン遺伝子クラスター
- 赤血球のヘモグロビンを構成するタンパク質をコードする遺伝子群。ヒトでは五つのβグロビン遺伝子が染色体上に並んで存在し、成長に合わせて胚型、胎児型、成人型へと発現する遺伝子が切り替わっていく。
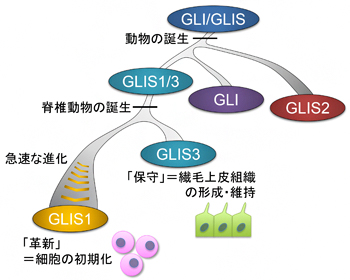
図1 GLIS1遺伝子の進化の歴史
遺伝子系統樹解析の結果、動物の誕生後まもなくしてGLIS1/3、GLI、GLIS2が分岐し、脊椎動物の誕生時に生じた全ゲノム重複によってGLIS1がGLIS3と分岐したことが分かった。また、GLIS1はGLIS3と分岐したのち、急速にその配列を進化させてきたことも明らかになった。これは、GLIS3が祖先遺伝子から受け継いだ役割(繊毛包皮組織の形成・維持)を「保守」する一方で、GLIS1が急速な進化を遂げて「革新」的機能(細胞の初期化)を獲得した可能性を示している。
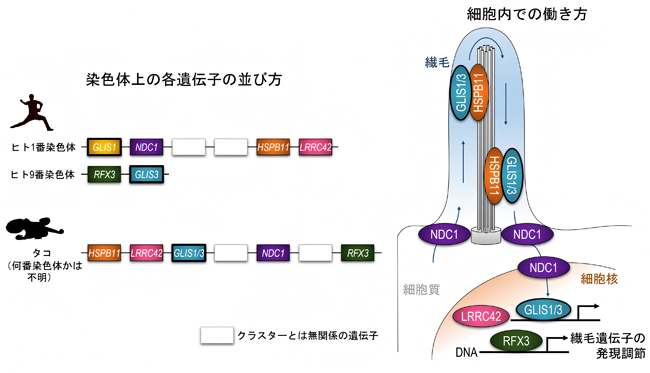
図2 繊毛遺伝子クラスター
ヒトの繊毛遺伝子クラスターは、全ゲノム重複の影響を受けて1番染色体と9番染色体に分かれて存在する。タコでは一つの染色体上にすべてのクラスター遺伝子が存在する。GLIS1/3、RFX3、LRRC42は細胞核内で遺伝子発現調節を行い、NDC1とHSPB11は核や繊毛でのタンパク質輸送に関わる。GLIS1/3は繊毛にも局在して外部からの刺激を検知していると考えられている。
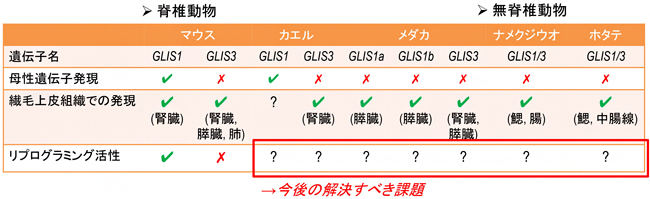
図3 これまでの研究成果と今後の課題
今回の研究で、遺伝子の由来と母性遺伝子発現および繊毛上皮組織での発現の有無は判明したが、哺乳類以外の遺伝子のリプログラミング活性については全く知見がない。今後はタンパク質の機能を比較することが重要になる。なお、メダカはGLIS1aとGLIS1bの二つのGLIS1遺伝子を持つ。