2021-03-19 理化学研究所
理化学研究所(理研)生命医科学研究センターヒト疾患モデル研究チームの石川文彦チームリーダー、齊藤頼子上級研究員、橋本真里基礎科学特別研究員らの共同研究グループは、白血病ヒト化マウス[1]を用いて、白血病細胞の”弱点”であるタンパク質の阻害剤を投与することで、白血病細胞を効果的に死滅させる方法を突き止めました。
本研究成果は、急性骨髄性白血病[2]の中でも、現在の治療法では治癒が困難とされる患者に対する個別化医療への実現につながると期待できます。
悪性度の高い急性骨髄性白血病では、患者ごとに異なる複数の遺伝子異常が生じるため、複雑な病状を抑え込む治療開発が困難な状況にあります。
今回、共同研究グループは、正常な血液と比べ、白血病細胞に多く存在する遺伝子を特定し、その機能を停止させることで患者白血病細胞が死滅するかどうかを調べたところ、IAP[3]、BCL2[3]、MCL1[3]、AURKB[4]、CENPE[4]という五つのタンパク質が白血病細胞の”弱点”であることが分かりました。各患者の白血病状態を再現した「白血病ヒト化マウス」を用いて、これらのタンパク質の機能を停止させる阻害剤を投与することで、骨髄・脾臓・血液中に存在する白血病細胞が効果的に死滅することを実証しました。しかし、五つのタンパク質の阻害剤に対して、全ての患者の白血病細胞が一様な感受性を示すわけではありません。そこで、患者ごとに発生している染色体や遺伝子(FLT3、MLL、NRAS、IDH1など)の異常を調べ、どの染色体や遺伝子に異常があれば、どのタンパク質の阻害剤が有効かを関連付けることで、個別最適化医療に結びつけました。
本研究は、科学雑誌『Nature Cancer』オンライン版(3月18日付:日本時間3月19日)に掲載されます。

無治療と最適治療後(IAP阻害剤+BCL2阻害剤)の白血病ヒト化マウスの骨
背景
白血病は、私たちの体をあらゆる病気から守る白血球が悪性化する血液がんです。白血病を発症すると免疫が失われることから、患者は感染症など他の病気の危険性も高まります。白血病の治療には、まず抗がん剤によりがん化した細胞(白血病細胞)を減らし、さらに大量の抗がん剤で治療した後に、骨髄や臍帯血を用いて造血幹細胞[5]を移植する方法が確立されています。しかしそれでもなお、いまだ根治を実現できずに再発し、命を失う患者も少なくありません。
理研では、難治性白血病患者の治療を牽引する虎の門病院血液内科との15年間にわたる共同研究の下、これまでに、急性骨髄性白血病の再発を引き起こす細胞や再発の原因に関する研究を発表してきました注1-4)。今回は、虎の門病院での診療において、完全な治癒に至らなかった患者検体を用いて、急性骨髄性白血病の再発克服と根治の実現を目指しました。白血病など血液を専門とする研究チームに加え、遺伝子計測、遺伝子解析、タンパク質の構造予測、機械学習など理研の三つの研究センターからなる計7研究チームで、虎の門病院血液内科のチームとともに研究を進めました。
注1)2017年10月26日プレスリリース「急性骨髄性白血病を克服する治療法」
注2)2013年4月18日プレスリリース「白血病再発の主原因「白血病幹細胞」を標的とした低分子化合物を同定」
注3)2010年2月15日プレスリリース「白血病再発を引き起こす白血病幹細胞の抗がん剤抵抗性の原因を解明」
研究手法と成果
急性骨髄性白血病を根治するには、増殖と生存を続ける悪性化した白血病細胞を死滅させる方法を見つける必要があります。正常なシステムを逸脱した細胞が骨髄や血液中で増殖し、抗がん剤投与後も生き続けるのは、正常な血液や免疫に不可欠な複数の遺伝子に異常が生じているからです。
共同研究グループはまず、現在の治療法では根治に至らなかった患者検体に集中して研究を進めることにしました。それぞれの細胞核に数万個存在する遺伝子はタンパク質を作り、複数のタンパク質が相互に作用し合いながら、細胞の特徴や機能を形成します。今回、患者の白血病細胞と正常な血液を作り出す造血幹細胞の遺伝子を比較し、造血幹細胞には少なく、白血病細胞に多い遺伝子を選び出しました。そして、これらの遺伝子から作られるタンパク質を治療標的の候補として、正常な血液や免疫を障害せず白血病細胞を選択的に治療する方法を探しました。
治療標的の候補となるタンパク質の働きを停止させる阻害剤を白血病細胞に与えた場合に、白血病細胞が実際に生存・増殖できなくなるかについて、試験管内で38種類の阻害剤を患者10人の白血病細胞に対して調べました。その結果に基づいて5種類の最も優れた阻害剤に絞り、さらに患者97人の白血病細胞を用いて検討を続けました。その結果、73人(73/107=68%)の患者で、IAPというタンパク質の機能が阻害されたときに、白血病細胞が最も有効に死滅することを発見しました。さらに他の患者では、BCL2、MCL1、AURKB、CENPEなどのタンパク質を標的とした場合にも白血病細胞が死滅しました。すなわち、これら五つのタンパク質が白血病の”弱点”であることを見いだしました。
以上のような試験管内での検討は、多くの患者白血病細胞に対して複数の阻害剤の影響を測定する上でメリットがあります。一方で、病気は生体内の特定の場所で発生し、白血病は骨髄で発症することから、生体内の骨髄、脾臓、血液などの場所で、治療効果を正確に定量的に評価することが重要です。
そこで、患者白血病細胞を用いて、患者それぞれの白血病の状態をマウスに再現した「白血病ヒト化マウス」を作製しました。白血病ヒト化マウスでは、骨髄で白血病細胞が増え始め、次第に骨髄から血液中に白血病細胞が出て、脾臓などの骨髄以外の組織に浸潤します。白血病ヒト化マウスが患者白血病状態を再現したことを確認した上で、IAP阻害剤とBCL2阻害剤、IAP阻害剤とAURKB阻害剤など、試験管内の検討で患者白血病細胞が特に高い感受性を示した阻害剤を2種類選んで投与しました。すると、血液中だけでなく骨髄や脾臓に存在していた白血病ヒト化マウスの患者由来白血病細胞も完全に死滅することが確認されました(図1、2)。さらに、他の阻害剤の組み合わせでも、それぞれ異なるメカニズムで患者由来白血病細胞が有効に死滅することが分かりました。
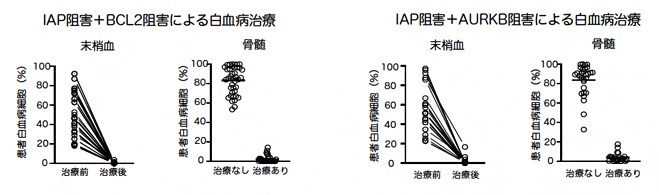
図1 白血病ヒト化マウスにおける2種類の阻害剤の同時投与による効果
遺伝子異常が患者ごとに違う急性骨髄性白血病では、IAPとBCL2の二つのタンパク質が弱点である患者、IAPとAURKBの二つのタンパク質が弱点である患者がいることを見つけた。それぞれの患者で弱点と分かった二つのタンパク質を阻害する薬剤(IAP阻害剤+BCL2阻害剤、IAP阻害剤+AURKB阻害剤)をそれぞれの白血病ヒト化マウスに投与したところ、末梢血、骨髄で患者由来白血病細胞が死滅した。
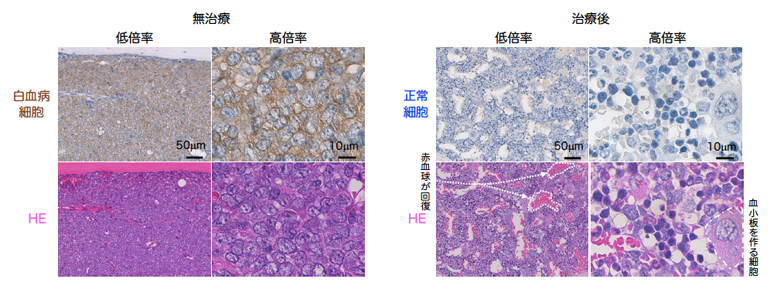
図2 無治療と治療後(IAP阻害剤+BCL2阻害剤)の白血病ヒト化マウスの骨の顕微鏡写真
左:上段は、無治療の白血病ヒト化マウスの骨の免疫組織染色の顕微鏡写真。患者由来白血病細胞がヒト化マウスの骨で激しく増殖し、正常な血液細胞は消失し、ほぼ全ての細胞が白血病細胞(褐色)であった。下段はHE染色の顕微鏡写真。
右:上段は、IAP阻害剤とBCL2阻害剤を同時投与した後の免疫組織染色の顕微鏡写真。褐色の白血病細胞が治療で完全に消失し、代わりに青色の正常な血液細胞が多数作られていることが確認された。下段はHE染色の顕微鏡写真。白血病細胞とは形の異なる赤血球や正常な白血球が回復し、ただ白血病細胞を殺しただけでなく、正常な細胞を殺すことなく回復させることが分かった。
最後に、患者体内で発生した遺伝子異常の種類と最適な治療を結びつけることを目指しました。同じ急性骨髄性白血病という診断がなされても、その原因となる遺伝子の異常は患者ごとに異なることが、遺伝子研究で明らかになりつつあります。つまり、五つのタンパク質の阻害剤に対して、全ての患者白血病細胞が一様な感受性を示すわけではありません。そこで、患者ごとに発生している染色体や遺伝子の異常(FLT3、MLL、NRAS、IDH1など)を調べ、どの染色体や遺伝子に異常があれば、五つのうちどのタンパク質が白血病の弱点であるかを関連付けることに成功しました。その例として、複雑なゲノム異常を持つ白血病患者にIAP阻害剤を用いた二つの治療結果を図3に示します。
今回の成果は、現在の治療で助けることのできない白血病の個々の患者に最適な治療を届け、治癒に導く可能性のある成果だといえます。
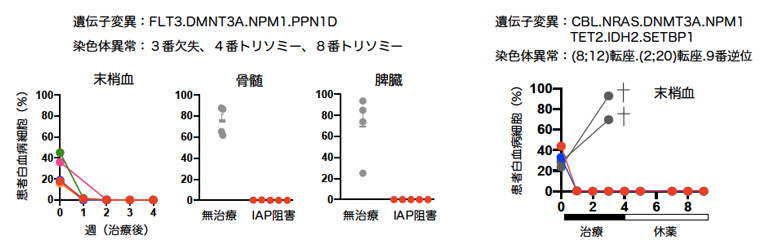
図3 複雑なゲノム異常を持つ白血病の克服
左:4種類の遺伝子変異と3種類の染色体異常を併せ持つ患者検体を用いて、白血病状態をヒト化マウスに再現した。この場合はIAPを阻害することで、抹消血中の白血病細胞は投薬後速やかに死滅し、投与から1カ月後に骨髄と脾臓を解析すると、白血病細胞が全て死滅したことが分かった。
右:7種類の遺伝子変異と3種類の染色体異常を併せ持つ患者検体を用いて、白血病ヒト化マウスを作製した。無治療の場合は、灰色の丸と線で示すように、末梢血中の白血病細胞は増加を続け、やがてマウスは死亡した。一方、赤と青の丸で示すように、IAP阻害剤とBCL阻害剤を同時に1カ月投与すると、白血病細胞の完全な死滅が確認された。さらに、次の1カ月は休薬して観察したが、再発の兆候はなく、強い治療効果が示された。
今後の期待
現在の医療では完全に克服することができない疾患が多く残されています。そのような難治性疾患を克服することこそ、医療・医学の使命といえます。今回の研究では、急性骨髄性白血病に対して、虎の門病院の医師たちの白血病診療の経験を起点として、理化学研究所の複数の専門分野の科学者が協力して克服を目指しました。専門家によって明らかにした結果を議論・評価し、統合的に解析・解釈することで、白血病細胞を死滅させる方法を突き止めました。患者への応用には引き続きさまざまな検証が必要ですが、本成果をもとに、個々の患者に最適な方法で、急性骨髄性白血病を完全に克服する新しい治療が確立されると期待できます。
さらに、本研究における複数の科学を融合させて難病を克服するアプローチが、急性骨髄性白血病以外の血液疾患や、さまざまな臓器に発生する固形がんの理解と克服にも応用・展開されることが期待できます。
補足説明
1.白血病ヒト化マウス
ヒトの免疫・血液システムが生体内でどのように作られ、その機能を発揮するか、さらにはヒトの病気がどのように発症するかを研究することは、倫理的観点からの問題があった。その制約を克服するために、ヒトの造血幹細胞を免疫のないマウス(免疫不全マウス)に注射することで、正常免疫系を再現した「免疫系ヒト化マウス」が開発された。白血病ヒト化マウスは、このシステムを白血病へ応用し、患者から得られた白血病の根幹となる細胞(白血病幹細胞)を免疫不全マウスに移植することで、患者それぞれの病態を再現するために作られたマウスである。
2.急性骨髄性白血病
成人に多い白血病の種類。慢性骨髄性白血病がフィラデルフィア染色体と呼ばれる一つの遺伝子異常で発生するのに対し、急性骨髄性白血病は患者ごとに異なる遺伝子異常が複数発生しているため、これまで治療開発が困難であった。
3.IAP、BCL2、MCL1
細胞の生死を決定するタンパク質は、細胞質内でミトコンドリアとそれ以外の部分に分かれて存在する。細胞が生存するように働くタンパク質と死滅するように働くタンパク質がバランスを保つことが、体内のさまざまなシステムを正常に作動するために重要である。BCL2やMCL1などのタンパク質がミトコンドリアに存在する一方、IAPはミトコンドリア以外の細胞質に存在し、細胞が死なないように作用している。これまでに、BCL2やMCL1は、悪性化した細胞が正しい寿命で細胞死をたどらずに長く生存する役割を担うという報告がある。一方、どのような疾患でどのような場合にそれぞれのタンパク質が重要であるかについては、いまだ不明である。
4.AURKB、CENPE
細胞が増える際に、細胞の遺伝子情報が含まれる核がその情報を2倍にしながら分裂し、続いて細胞全体が分裂する。白血病細胞などのがん細胞の分裂速度は正常細胞よりも速い。AURKBとCENPEはいずれも細胞分裂に必要なタンパクであり、正常な造血幹細胞には少ない一方で白血病細胞では多いことが今回判明した。今回、これらのタンパク質の働きを停止させることで、白血病細胞が死滅することを見つけた。
5.造血幹細胞
血液・免疫システムは、10種類以上にも及ぶ多彩な細胞から構成される。全ての細胞を、私たちヒトの一生にわたって供給するのが造血幹細胞である。骨髄移植や臍帯血移植などで患者を助けられるのも、骨髄に含まれる造血幹細胞が患者に移植された後、長期間、患者が必要とする全ての血液・免疫細胞を作り出すためである。
共同研究グループ
理化学研究所
生命医科学研究センター
ヒト疾患モデル研究チーム
チームリーダー 石川 文彦(いしかわ ふみひこ)
上級研究員 齊藤 頼子(さいとう よりこ)
基礎科学特別研究員 橋本 真里(はしもと まり)
大学院生リサーチ・アソシエイト 中川 諒(なかがわ りょう)
基盤技術開発研究チーム
チームリーダー 桃沢 幸秀(ももざわ ゆきひで)
専門技術員 飯島 花枝(いいじま はなえ)
テクニカルスタッフ 髙田 定暁(たかた さだあき)
テクニカルスタッフ 遠藤 ミキ子(えんどう みきこ)
応用計算ゲノミクス研究チーム
チームリーダー ミヒル・デ・ホーン(Michiel de Hoon)
技師 ジェシカ・セヴェリン(Jessica Severin)
客員研究員 ジョーダン・ラミロフスキー(Jordan Ramilowski)
(横浜市立大学 先端医科学研究センター 准教授)
応用ゲノム解析技術研究チーム
チームリーダー 岡崎 康司(おかざき やすし)
統合ゲノミクス研究チーム
チームリーダー(研究当時) 小原 收(おはら おさむ)
(かずさDNA研究所 副所長)
生命機能科学研究センター 制御分子設計研究チーム
チームリーダー 本間 光貴(ほんま てるき)
研究員 幸 瞳(ゆき ひとみ)
革新知能統合研究センター 汎用基盤技術研究グループ
高次元統計モデリング研究チーム
チームリーダー 山田 誠(やまだ まこと)
科技ハブ産連本部 創薬・医療技術基盤プログラム
マネージャー 深見 竹広(ふかみ たけひろ)
虎の門病院
副病院長・血液内科部長 谷口 修一(たにぐち しゅういち)
血液内科部長 内田 直之(うちだ なおゆき)
医長 高木 伸介(たかぎ しんすけ)
原論文情報
Mari Hashimoto*, Yoriko Saito*, Ryo Nakagawa, Ikuko Ogahara, Shinsuke Takagi, Sadaaki Takata, Hanae Amitani, Mikiko Endo, Hitomi Yuki, Jordan A. Ramilowski, Jessica Severin, Ri-ichiro Manabe, Takashi Watanabe, Kokoro Ozaki, Akiko Kaneko, Hiroshi Kajita, Saera Fujiki, Kaori Sato, Teruki Honma, Naoyuki Uchida, Takehiro Fukami, Yasushi Okazaki, Osamu Ohara, Leonard D. Shultz, Makoto Yamada, Shuichi Taniguchi, Paresh Vyas, Michiel de Hoon**, Yukihide Momozawa**, Fumihiko Ishikawa(*、**は同じ役割・貢献を果たした著者), “Combined inhibition of XIAP and BCL2 drives maximal therapeutic efficacy in genetically diverse aggressive Acute Myeloid Leukemia”, Nature Cancer, 10.1038/s43018-021-00177-w
発表者
理化学研究所
生命医科学研究センター ヒト疾患モデル研究チーム
チームリーダー 石川 文彦(いしかわ ふみひこ)
上級研究員 齊藤 頼子(さいとう よりこ)
基礎科学特別研究員 橋本 真里(はしもと まり)
報道担当
理化学研究所 広報室 報道担当