MRSAが体の免疫システムによる検出を回避するために採用する戦略を明らかにするツールが、バース大学で開発されました。 A tool that promises to throw light on the strategies adopted by MRSA to avoid detection by the body’s immune system has been developed at Bath.
2022-10-17 バース大学
このツールは、微生物表面のこのタンパク質のレベルを測定することにより、黄色ブドウ球菌がヒトに病気を引き起こすメカニズムを研究者が理解するのに役立つと期待されている。
この新しいツールは、補体として知られる免疫システムの一部に属するタンパク質であるC3を測定するものである。補体は、感染症に対する身体の防御において中心的な役割を担っている。
すべてが順調に進むと、侵入してきた微生物を最初に発見したときに、補体系(50種類のタンパク質とタンパク質断片から成る)が動き出す。このシステムは、他の免疫システムを強化し、体内の侵入者を調査し、細菌の細胞壁を破裂させ、微生物を免疫細胞に知らせ、その脅威を排除するのである。
成功した病原体はすべて、補体に対する抵抗機構を進化させており、このシステムを巧みに回避する病原体ほど、健康に害を及ぼす可能性が高いのである。
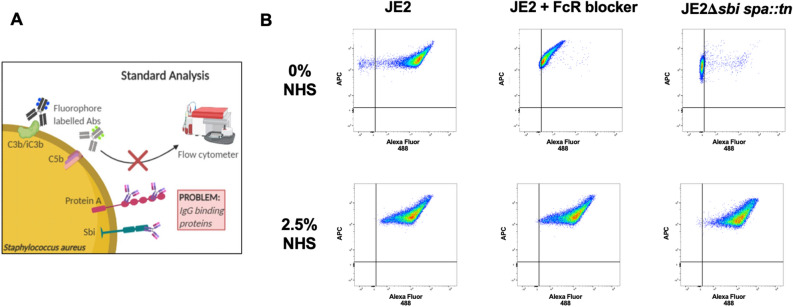
これまで、補体をブロックする病原体主導の事象の正確なシーケンスを解明することは、C3を正確に測定するツールがないために妨げられていた。今回開発された検出方法は、信頼性の高い正確な測定を可能にする初めての方法であると考えられる。
<関連情報>
- https://www.bath.ac.uk/announcements/new-tool-helps-scientist-understand-how-mrsa-superbug-avoids-immune-detection/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9492775/
黄色ブドウ球菌の補体C3沈着量を検出する新規な方法 Novel method for detecting complement C3 deposition on Staphylococcus aureus
Toska Wonfor, Shuxian Li, Rhys W. Dunphy, Alex Macpherson, Jean van den Elsen and Maisem Laabei
Scientific Reports Accepted 2022 Sep 8.
DOI:: 10.1038/s41598-022-20098-7
Abstract
The primary host response to Staphylococcus aureus infection occurs via complement. Complement is an elegant evolutionarily conserved system, playing essential roles in early defences by working in concert with immune cells to survey, label and destroy microbial intruders and coordinate inflammation. Currently the exact mechanisms employed by S. aureus to manipulate and evade complement is not clear and is hindered by the lack of accurate molecular tools that can report on complement deposition on the bacterial surface. Current gold-standard detection methods employ labelled complement-specific antibodies and flow cytometry to determine complement deposited on bacteria. These methods are restricted by virtue of the expression of the S. aureus immunoglobulin binding proteins, Protein A and Sbi. In this study we describe the use of a novel antibody-independent C3 probe derived from the staphylococcal Sbi protein, specifically Sbi-IV domain. Here we show that biotin-labelled Sbi-IV interacts specifically with deposited C3 products on the staphylococcal surface and thus can be used to measure complement fixation on wild-type cells expressing a full repertoire of immune evasion proteins. Lastly, our data indicates that genetically diverse S. aureus strains restrict complement to different degrees suggesting that complement evasion is a variable virulence trait among S. aureus isolates.