2022-11-01 量子科学技術研究開発機構
発表のポイント
- 多項目血液バイオマーカーの包括的な解析によって、糖尿病患者で最初に出現する変化は、脳内のミクログリア1)機能の低下を示唆する血中sTREM22)の低下であり、それは認知機能が正常な時期から出現することを、世界で初めて明らかにしました。
- また、アルツハイマー病の多項目バイオマーカーを血液で解析することにより、糖尿病患者では、脳内でのアミロイドβ(Aβ)3)蛋白蓄積を反映する血中Aβ42/40比の低下を認めないにもかかわらず、その下流にある脳内タウ蛋白蓄積を反映する血中リン酸化タウ(pTau)蛋白3)の上昇を認めました。これは、羽生らが報告している「糖尿病性認知症」の特徴と一致しており、今回の研究によって糖尿病性認知症という疾患単位を規定する特徴的なバイオマーカーの時系列変化を初めて明らかにしました。
- 糖尿病患者で認められる血液バイオマーカー変化の時系列、すなわちsTREM2の低下から始まって、その後にAβ42/40比の低下を伴わないpTau上昇を呈することを示し、脳内のミクログリア機能の低下が糖尿病性認知症の発症機序カスケードの最上流にあり、それに続くアルツハイマー病理変化の発現様式に影響を与えるという仮説を初めて提唱しました。
- 本成果は、糖尿病性認知症の発症・進展機序の解明に繋がるのみならず、認知症発症リスクの高い糖尿病患者を認知症発症以前の超早期に血中sTREM2によって簡便かつ客観的に同定することができるという、sTREM2の血液バイオマーカーとしての有用性を示しています。
研究の概要
国立病院機構京都医療センター臨床研究センター・浅原哲子部長は、同・山陰一主任研究員、健康科学大学・田中将志教授、京都認知症総合センタークリニック・秋口一郎所長、川崎照晃院長、及び国立研究開発法人量子科学技術研究開発機構(QST)・徳田隆彦医長を中心とする研究チームと共同で、糖尿病患者と非糖尿病患者を対象に、認知症に関連する血液バイオマーカーと認知機能との関連を検討しました。具体的には、脳内の老廃物などを掃除するミクログリア細胞の機能を反映する血中sTREM2および世界標準となっているアルツハイマー病の多項目血液バイオマーカー(Aβ42/40比、pTau、ニューロフィラメント軽鎖(NfL)など)を測定して、患者の認知機能障害の程度によって分類した正常群・軽度認知障害群・認知症群の間で、これらの血液バイオマーカーの変動を解析しました。その結果、糖尿病の認知症発症を最も早期に反映する指標は、血液中のsTREM2の減少である可能性を、世界で初めて明らかにしました。
さらに、糖尿病患者では、sTREM2の低下の後に続く変化として、脳内でのAβ蛋白蓄積を反映する血中Aβ42/40比の低下を認めないにもかかわらず、その下流にあって神経細胞障害に直結する脳内タウ蛋白蓄積を反映する血中pTauの上昇を認めました。これは、羽生らが提唱している「糖尿病性認知症」の特徴に合致しており、糖尿病性認知症という疾患単位を規定する特徴的なバイオマーカーの時系列変化を、世界で初めて明らかにしました。
本成果は、糖尿病性認知症の発症・進展機序の解明に繋がるのみならず、血中sTREM2の測定は、認知症発症リスクの高い糖尿病患者を認知症発症以前の超早期に、簡便かつ客観的に同定することができる血液バイオマーカーとして極めて有用であると考えられます。さらに、糖尿病患者で血中sTREM2が高値の患者を対象に予防的介入を行うことで、認知症リスク低減に寄与できる可能性が期待されます。
本研究論文は、糖尿病専門誌Diabetes Research and Clinical Practice誌のオンライン版に掲載されました(日本時間2022年10月19日)。
研究の目的
超高齢化社会が進む日本では、認知症患者の増加が社会問題となっています。2025年には高齢者の5人に1人が認知症になると推計され、認知症による社会的コストは年間10兆円を超えると推定されています。認知症の原因となる疾患には多様な疾患が含まれますが、その中で最も多い原因疾患がアルツハイマー病であり、認知症全体の60〜70%を占めており、さらに、高齢になる程その有病率が著明に増加します。また、同じく人口の高齢化によって高齢者糖尿病が著しく増加していて、厚生労働省の国民健康・栄養調査によると、糖尿病が強く疑われる成人患者の数は2016年時点で推計1,000万人を超えており、年齢が高いほど糖尿病有病者の割合が高くなります。さらに、近年の疫学研究により、糖尿病は脳血管性認知症のリスクであるだけでなく、アルツハイマー病の発症リスクを2倍以上上昇させると報告されています。以上のことからは、糖尿病の適切な管理は認知症患者の増加抑制に極めて重要であると考えられます。また、逆の観点から、認知機能低下は糖尿病治療の遵守や患者の健康寿命に悪影響を及ぼすため、糖尿病患者における認知症対策は喫緊の課題であり、認知症未発症段階における糖尿病患者の適切な管理と予防のためには、どのような糖尿病患者が認知症を発症するかを予測する非侵襲的で簡便な血液バイオマーカーの開発が急務となっています。本研究では、糖尿病患者において認知症の発症を予測できる実臨床に応用が可能な血液バイオマーカーを探索するとともに、糖尿病性認知症の脳病態の進展過程をバイオマーカーの観点から明らかにしたいと考えました。
研究の背景
アルツハイマー病においては、脳の中で作られた可溶性の毒性Aβ蛋白が、タウ蛋白のリン酸化と細胞内への蓄積を引き起こし、そのリン酸化タウ蛋白が大脳皮質に広がることによって大脳の神経細胞が広汎に障害されて、認知症を発症すると考えられています(図1参照)。そのため、可溶性の毒性Aβが脳全体に拡散しないように、通常の病初期にはミクログリアという細胞が働いて、Aβを不溶化して局所(老人斑と呼ばれる異常構造物)に閉じ込め、さらにミクログリアが老人斑周囲を取り囲みAβの拡散を防ぐ「バリア」となって、周囲の脳組織を保護していると考えられています。加齢などによって、このアルツハイマー病の病初期に働くミクログリアの保護的な活動が低下すると、Aβの拡散からリン酸化タウの誘導、細胞障害というアルツハイマー病理の進展カスケードが作動してしまいます。この考えを支持する知見として、ミクログリアに発現しているtriggering receptor expressed on myeloid cell 2 (TREM2)の遺伝子変異(TREM2の機能が低下)がアルツハイマー病の発症リスクを上げることが2013年に報告されました(図2)。TREM2はその一部が可溶型TREM2(sTREM2)として放出され、そのsTREM2の量はミクログリアの活性化状態を反映しており、sTREM2はヒトの脳脊髄液および血液中でも定量することができます。さらに、重要な報告として、2022年の3月には、家族性アルツハイマー病患者を登録して縦断的な研究を行っている米国のDIAN研究から、脳脊髄液中のsTREM2濃度が高かった家族性アルツハイマー病の保因者ではその後の脳萎縮・認知機能低下が遅かったことが示されています。
また、上記のように、糖尿病は認知症のリスク因子であることが分かっています。糖尿病患者に出現する「糖尿病性認知症」においては、アルツハイマー病とは異なる脳病理の特徴が、羽生らによるPET検査4)を用いた研究によって報告されています。それは、アルツハイマー病の最初期病変である老人斑(Aβ蓄積から構成)の形成がわずかであり、一方、Aβの下流にあるリン酸化タウタンパク質は蓄積し、認知機能が低下することが認められていました。しかしながら、糖尿病性認知症に関しては、その発症・進展機序の詳細は解明されておらず、低侵襲で安価な診断法や認知症発症予測バイオマーカーも開発されていません。
一方、アルツハイマー病の研究領域では、その脳病変の進展状況に対応する脳脊髄液バイオマーカー(ATNバイオマーカー)5)が確立されており、多項目のバイオマーカーが脳病態の進展に応じて変化していく時系列が明らかになっています(図1)。また、近年の顕著な技術的進歩により、従来は脳脊髄液中でしか測定できなかったこれらのアルツハイマー病関連バイオマーカーが、この2,3年で急速に血液中でも測定できるようになってきています。特に、脳内の不溶性Aβアミロイドの沈着量を反映する(ATNの”A”バイオマーカー)血中のAβ42/ 40比(分子の長さが異なるAβ42とAβ40の量比)、血中リン酸化タウ蛋白(pTau: ATNの”T”バイオマーカー)、および血中ニューロフィラメント軽鎖(NfL)が、世界標準のアルツハイマー病の血液バイオマーカー(ATNバイオマーカー)となっています(図1)。アルツハイマー病では、上記のように、脳内に不溶化したAβ42を主体とする老人斑が形成されるため血液中の可溶性Aβ42/40比は低下し、一方、脳にリン酸化タウ蛋白が増えて神経細胞が障害されるため、血液中のpTauとNfLは増加することが判っています。
本研究の研究代表者である浅原哲子部長は、これまでに、sTREM2が糖尿病患者の認知機能低下と関連していること(Diabetes Metab 2019)、および世界でも最高水準の地域住民を対象にした疫学研究である久山町研究の住民コホート(コホートとは「集団」のこと)で、血中sTREM2が認知症の新規バイオマーカーとなることを報告しています(Annals of Neurology 2019)(図3)。また、本研究に参加している量研機構(QST)の徳田隆彦医長は、認知症のバイオマーカー研究に長年の間従事しており、アルツハイマー病の病因蛋白であるp-tauをヒト血液中で検出できる測定系を世界で初めて開発し、アルツハイマー病診断におけるその有用性を報告しています(Mol Neurodegener 2017)(図4)。また、徳田医長は国際的に標準となっているアルツハイマー病のATNバイオマーカーを、全て血液中で測定できる技術を有している我が国では数少ない研究者であり、本研究でもそれらの多項目血液バイオマーカーを包括的に検討しました。
研究の内容:方法と成果
本研究では、京都認知症総合センタークリニックで経過観察と加療を受けている糖尿病患者(47名)と非糖尿病患者(74名)を対象にして、糖尿病の病歴と経過、認知機能検査、画像診断などの臨床情報を収集し、また保存されていた血液検体を用いて、ミクログリアの機能を反映する血中sTREM2およびアルツハイマー病の多項目血液バイオマーカー(ATNバイオマーカー: Aβ42/40比、pTau、NfLなど)を測定して、患者の認知機能障害の程度によって分類した正常群・軽度認知障害群・認知症群の間で、これらの血液バイオマーカーの変動を解析しました(図5)。sTREM2の測定はa RayBiotech Human TREM-2 ELISA法6) (RayBiotech, USA)で行いました。また、アルツハイマー病関連バイオマーカーについては、ヒト血液中に極微量しか存在せず従来は測定ができなかったのですが、近年に開発された超高感度デジタルELISAマシンSimoa7) (Quanterix, USA; 図6)を日本で最初に導入している徳田らは、アルツハイマー病のコア・バイオマーカーである上記のATNバイオマーカーのすべてをヒトあるいはモデル動物の血液中で測定可能になっています。以上の技術を用いて、本研究では、糖尿病患者と非糖尿病患者の血液中のsTREM2濃度およびAβ42/40比、pTau、NfL濃度を全症例で測定し、糖尿病の有無および認知機能障害の重症度と血液バイオマーカーの変動との関連を詳細に検討しました。。
その結果、糖尿病性患者群においては、最も早期である未だ認知機能が正常な時期において、sTREM2の血中濃度が非糖尿病患者群よりも有意に低下していました(図7A)。さらに、糖尿病患者では、正常からMCI(軽度認知障害)、そして認知症へと認知機能障害が進展するとともに血中sTREM2濃度がさらに減少する一方で、血中Aβ42/40比は変化せず、しかしながら血中pTau濃度は増加することが判明しました(図7B,C)。他方、非糖尿病患者群では、認知機能障害の進展とともに、血中Aβ42/40比が低下し、血中pTau濃度が増加するというアルツハイマー病の経過に典型的なパターンを呈していました。
以上の結果は、これらの血液バイオマーカーについて、これまでは提唱されていなかった糖尿病性認知症に特徴的な、血液バイオマーカーの連鎖的変動(カスケード)があることを示唆しています。すなわち、糖尿病患者群では、血中sTREM2の低下から始まって、Aβ42/40比の低下を伴わないpTau上昇を呈していました。個々の血液バイオマーカーは、それぞれ脳内のミクログリアおよび病期別のアルツハイマー関連脳病理の進展を反映すると考えられていますので(図1)、これらの血液バイオマーカーの動態から、糖尿病患者の脳内で生じている認知症に関連する複数の病態の時系列が推定できます(図8)。それは、脳以外の全身臓器でも炎症治癒過程が遷延するのと同様に、まず脳内のミクログリアの機能が糖尿病によって低下するという病態が最初に生じます。これによって、加齢とともに脳内で増加するAβ蛋白を不溶化して老人斑として隔離することでその毒性を軽減するという、ミクログリアが担当している「毒性可溶性Aβの隔離機能」および「老人斑を取り囲んで周囲の脳組織を毒性Aβから保護するというバリア機能」が減弱して、可溶性の毒性Aβが脳組織に拡散します。そして、この毒性Aβによってタウ蛋白の過剰なリン酸化や凝集化などの異常反応が誘導されて、異常タウ蛋白による神経細胞障害が惹起され、最終的には認知機能障害を発症する、というカスケードです(図8,9)。
このように、本研究では、脳内のミクログリア機能の低下が、糖尿病性認知症の発症を惹起する連続的な病的分子機構(カスケード)の最上流に位置していて、糖尿病性認知症の発症機序にとって最も重要であり、それに続くアルツハイマー病理変化の発現様式に影響を与えるという仮説を初めて提唱しました(図9)。
まとめと今後の展開
上記のように、本研究では、脳内のミクログリア機能の低下が、糖尿病性認知症の発症を惹起する連続的な病的分子機カスケードの最上流に位置していて、それに続くアルツハイマー病理変化の発現様式に影響を与えるという仮説を初めて提唱しました。今回の研究成果は、このような糖尿病性認知症の発症・進展の機序の解明に繋がるのみならず、臨床的にもアクセスしやすく安価な血液検査によって血中sTREM2量を測定することで、認知症発症リスクの高い糖尿病患者を簡便かつ客観的な方法で超早期から同定する方法の開発に貢献できると考えられます(図9)。さらに、糖尿病性認知症に対するミクログリア機能を標的にした新規の治療法の開発や糖尿病患者に対する生活指導・食事指導・運動療法などの介入などの局面においても、血中sTREM2および多項目アルツハイマー病関連血液バイオマーカーは治療効果の予測やモニタリングに使用することができます。
また、すでに臨床的・画像診断的観察から提唱されていた「糖尿病性認知症」の病態、すなわち「脳内のAβアミロイドの沈着が少ないにもかかわらずタウ病理が出現する(以下⓵)」という仮説についても、今回の研究によって、バイオマーカーの観点からAβとタウの上流にミクログリアの機能低下という病態を推定することで、そのような「糖尿病性認知症」の脳病態(⓵)を説明することが可能になりました(図8)。「糖尿病性認知症」については、これまでどのよう分子機構でそのような病態(⓵)が出現するのかが明らかではなく、根本的にそのような病態が存在するのかということにも疑念を呈する意見がありましたが、今回の研究により、「糖尿病性認知症」の発症病態の仮説を体系化することができました。今後、「糖尿病性認知症」は、アルツハイマー病とも連続する新しい認知症の原因疾患の一つとして、より大規模な臨床研究やモデル動物などの基礎研究によって、その疾患概念が確立されていく可能性があり、我々の研究結果はその扉を開いたと考えています。
我々も、今後、さらなる研究により、糖尿病性認知症の効果的な予知指標・診断法・治療戦略の開発に取り組んでいきたいと考えています。
用語解説
1) ミクログリア
グリア細胞という神経系を構成する神経細胞以外の多様な細胞の一種で、脳内の免疫を担当する細胞。炎症に関連した生理活性物質の産生と放出を行うとともに、脳内の老廃物や視細胞などの不要物を貪食する能力を有しています。
2) TREM2, sTREM2
TREM2はtriggering receptor expressed on myeloid cell 2の略で、膜貫通型の自然免疫受容体であり、アルツハイマー病の発症リスクに関わる遺伝子の一つとして報告されています。TREM2は脳でミクログリアに存在している蛋白質ですが、タンパク分解により切断され、可溶型(sTREM2: soluble TREM2)として、脳脊髄液や血液に分泌されます(図10)。アルツハイマー病患者の脳脊髄液では、sTREM2の濃度が増加しています。さらに、TREM2遺伝子のR47HおよびR62H変異は、アルツハイマー病発症リスクの上昇に関連しています(図2)。
また本研究の代表者である浅原は、質の高い地域住民コホート研究(コホートは「集団」の意味)として世界的に有名な久山町研究との共同研究で、久山町高齢住民約1,300名を10年間前向きに追跡し、血清sTREM2レベルと認知症発症の関係を検討しました。その結果、血清sTREM2値の上昇に伴い、全認知症、アルツハイマー型認知症、および血管性認知症の発症リスクがいずれも有意に上昇することが判明し、さらに、認知症の危険因子と血清sTREM2値を組み合わせることにより、将来の認知症発症の予測精度が有意に改善することを、2018年に明らかにしています(図3)。
3) Aβ(アミロイドβ)蛋白、リン酸化タウ蛋白(pTau)
いずれもアルツハイマー病患者の脳に異常に蓄積する病因蛋白質です。この2つの蛋白質が、それぞれ細胞外、細胞内に蓄積することがアルツハイマー病の病理学的な特徴です(図1)。Aβ蛋白は、正常な細胞の代謝過程でも脳内で産生されていて、それぞれ40個と42個のアミノ酸から構成されているAβ40とAβ42が主要なAβ蛋白分子種です。両者の産生比は9:1で、Aβ40がメインのAβなのですが、Aβ42は凝集しやすく病原性が高いと考えられています。脳内で最初に出現する異常蛋白はAβ42であり、神経細胞の外に蓄積して病理学的には老人斑という構造物になりますが、このAβの蓄積だけでは明らかな認知機能障害は生じません。Aβが蓄積している老人斑周囲で神経細胞の突起が変性を起こし、その変性神経突起内に蓄積する異常にリン酸化されたタウ蛋白が、脳全体に広がっていくことによって、大脳の広い範囲で神経細胞障害が生じてアルツハイマー病の認知機能障害が引き起こされます(図1)。以上のようなアルツハイマー病の発症に関わる分子メカニズムは、これまでの多くの国際的な研究によって得られた研究成果を基にして提唱されたものです。また、これらのアルツハイマー病患者の脳内に蓄積するAβ、リン酸化タウは、以前は死後の病理解剖でしかわからなかったのですが、近年では、これらの異常蛋白に特異的に結合する物質を放射性同位元素で標識して人体に投与して、その結合を画像化するPET(陽電子放射断層撮影)検査ができるようになり、患者の生前にこれらの異常蛋白の脳内蓄積量が定量できるようになっています。QSTは世界で最初に異常タウ蛋白のPETによる画像化に成功しています。さらに、最近では、このPET検査でAβやリン酸化タウ蛋白の蓄積を同定した患者で、各種の方法でAβ、リン酸化タウを血液中で測定して比較することで、血液バイオマーカーによっても脳内にこれらの蓄積蛋白が存在するか否かを判定できるようになっています。QSTの徳田は世界で初めて、pTauを血液中で定量する測定系を開発しました。QSTでは、Aβ、タウ以外にも様々な認知症関連蛋白質をPET画像と血液バイオマーカーで包括的に診断するために、画像・血液バイオマーカーを一体化させた多項目バイオマーカーによる認知症診断システムの確立に取り組んでいます(図11)。
4) PET
PETとは、positron emission tomography(陽電子放出断層撮影)の略で、放射能を含む薬剤を用いる核医学的検査の一種です。放射性薬剤を体内に投与し、その分析を特殊なカメラでとらえて画像化します。これまではPET検査といえば、大半がブドウ糖代謝の指標となる18F-FDGというくすりを用いた「FDG-PET検査」で、がんや炎症の病巣を調べたり、転移状況や治療効果の判定、再発の診断などに利用されてきました。最近では、アルツハイマー病の脳に沈着するAβ蛋白やリン酸化タウ蛋白に結合する薬剤を放射性標識して、これらの異常蛋白を患者の存命中に画像化する技術が登場しています。QSTは世界で初めて、異常タウ蛋白を画像化するPET検査の開発に成功して、認知症のPET検査では世界をリードしています(図11)。
5) ATNバイオマーカー(図1)
アルツハイマー病の原因蛋白であるAβの脳内蓄積は、記憶障害発症の10~20年前に始まることから、アルツハイマー病は臨床症状ではなく、脳病理に基づいた診断と分類が必要となっていました。このような状況から、2018年にアルツハイマー病の脳病態を、客観的に測定できるバイオマーカー(画像・体液バイオマーカー)によって診断・分類しようとする目的で、アルツハイマー病の脳病理をATN(A:Aβアミロイド、T:タウタンパク質、N:神経変性/神経損傷)バイオマーカーで分類するATNシステムが策定されました。ATNシステムでは、アルツハイマー病の脳病理は連続性を持って変化すると考えられていて、バイオマーカー技術の進展で、認知症を発症する以前のプレクリニカル期を含むアルツハイマー病の疾患ステージを生物学的な観点から正確に診断することが可能になっています。さらに、ATNバイオマーカーによる脳病理ステージの的確な診断、予後の予測から分子病態に基づいた治療薬の選択を行うことが可能になると予想されるので、最も治療効果の高いプレクリニカル期の段階での治療介入も考慮されるようになってきています。
ATNバイオマーカーには、その方法として画像バイオマーカーと体液バイオマーカー(体液ではA,T,NはそれぞれAβ42/40比、pTau、NfL)がありますが、本研究に参加した徳田が所属するQSTでは、すべてのATNバイオマーカーを、画像(PET)バイオマーカーと血液バイオマーカーによって測定することが可能になっています(図1)。このような研究機関は国内ではQSTのみで、世界的にも非常に限られています。
6) ELISA法
Enzyme-Linked Immuno Sorbent Assayの略で、「エライザ」と読みます。これは、試料溶液中に含まれている目的の抗原(バイオマーカーでは検出したい蛋白質、例えばアルツハイマー病なら原因蛋白であるAβやリン酸化タウなど)を、その抗原を特異的に認識する特異抗体で捕捉するとともに、酵素反応を利用して検出・定量する方法です。2種類の特異抗体を、抗原の捕捉(捕捉抗体)と検出(検出抗体)で挟み込んで検出するELISA法をサンドイッチELISAと呼びますが(図12)、単一の抗体で検出するよりも、反応全体の標的抗原に対する特異性が高くなって検出の精度が上がるので、臨床的に有用な血液中の蛋白質(例えば前立腺がんのマーカーであるPSAなど)を検出する際に用いられる標準的な方法となっています。
図12では、マイクロプレートに目的タンパク質に対する捕捉抗体(オレンジ色)を固定(固相化)し、目的タンパク質を反応させます。続いて酵素標識した目的タンパク質に対する別の抗体(検出抗体, 緑色)を反応させ、洗浄後、マイクロプレートに残る酵素活性を検出します。この時、固相化した抗体(オレンジ)と酵素標識抗体(緑)の抗原認識部位は異なっている必要があります。
7) Simoa
Single molecular arrayの略で、2010年に発表された極微量タンパク質の定量技術(図6)。従来からバイオマーカーの定量に用いられていたELISA法などと同様に、捕捉抗体と検出抗体のサンドイッチ法により標的抗原を検出しますが、捕捉抗体を固定化したビーズを極めて微小なウェルに導入することによって、標的抗原を検出するための酵素光反応の減衰を最小限にして、極微量の抗原を検出できるようになっています。この方法により、従来のサンドイッチELISA法で用いていた同じ捕捉抗体と検出抗体のセットを用いても、標的抗原の検出感度を500倍から1000倍に増強することができます。米国Quanterix社がこの技術を製品化しており、徳田はこのSimoaを国内のアカデミアでは最初に導入して、2017年には、アルツハイマー病の病因分子であるpTauをヒトの血液中で定量する測定系を世界で初めて開発しました(図4)。
参考図
図1.アルツハイマー病の脳病理の進展過程とそれを反映するATNバイオマーカー

図2. TREM2遺伝子変異はアルツハイマー病の発症リスクを増大させる

図3. 研究代表者の浅原らは2019年に久山町研究との共同研究で、地域住民で測定した血中sTREM2濃度が10年後の認知症発症リスクの指標となることを報告した

図4. QSTの徳田らは2017年に世界で初めてヒト血液中のpTau定量が可能な測定系を開発

図5. 本研究で対象とした糖尿病患者群と非糖尿病群および本研究での評価項目
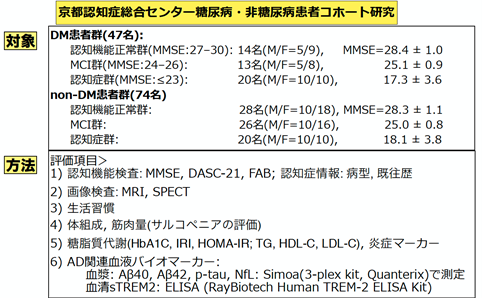
図6. 本研究でアルツハイマー病関連血液バイオマーカーの測定に用いた超高感度digital ELISAシステム(Simoa)

図7. 糖尿病患者群・非糖尿病患者群の認知機能障害度別(Normal, MCI, Dementiaの3群)の多項目血液バイオマーカー測定値の結果と統計学的解析

図8. 糖尿病患者及び非糖尿病患者の脳内で生じている認知症に関連する病態の時系列とそれらを反映する血液バイオマーカー

図9. 糖尿病性認知症の分子病態進展の時系列と将来の認知機能障害発症の新規予測マーカーとしてのsTREM2の有用性

図10. TREM2について

図11. QST(量子科学技術研究開発機構)で展開中の画像・血液バイオマーカーの相互促進的な開発とそれらを統合した包括的な認知症診断システム

図12. サンドイッチELISAの概要

研究助成
本研究は、一部、次の助成を受けて行われました:JSPS科研費[JP18H02737(浅原)、21H02835(浅原)、JP18K19769(浅原)、JP19K07905(山陰)、JP22K11720(山陰)、JP22K07456(田中)]、公益財団法人 喫煙科学研究財団(2019T004)(浅原)、公益財団法人 武田科学振興財団(浅原)、国立研究開発法人日本医療研究開発機構[AMED, JP21dk0207055h0001(徳田)、JP21ae0101077003(徳田)]。
論文情報
タイトル: Soluble TREM2 and Alzheimer-related biomarker trajectories in the blood of patients with diabetes based on their cognitive status
掲載雑誌(糖尿病専門誌): Diabetes Research and Clinical Practice,
掲載論文: https://www.diabetesresearchclinicalpractice.com/article/S0168-8227(22)00935-4/fulltext
研究チーム
浅原 哲子1,2*, 山陰 一1, 田中 将志1,3, 川崎 照晃4, 松浦 沙世5, 建部 陽嗣5, 秋口 一郎4, 徳田 隆彦5¶
1)国立病院機構京都医療センター 臨床研究センター 内分泌代謝高血圧研究部
2)名古屋大学 環境医学研究所 メタボ栄養科学研究部門
3)健康科学大学 健康科学部 理学療法学科
4)康生会武田病院神経脳血管センター
5)国立研究開発法人量子科学技術研究開発機構 脳機能イメージング研究部
†論文筆頭著者:浅原 哲子
*論文責任著者:浅原 哲子
¶論文最終著者:徳田 隆彦
(以上、論文掲載順)


