インテグリンを “オフ “にすることで、多発性硬化症などさまざまな疾患に対する新しい医薬品の開発につながる可能性があります。 Turning an integrin “off” could be the key to new pharmaceuticals for a wide range of conditions, including multiple sclerosis.
2022-12-19 アルゴンヌ国立研究所(ANL)
しかし今回、ボストン小児病院とハーバード大学の研究者たちが、米国エネルギー省(DOE)科学局のユーザー施設であるアルゴンヌ国立研究所のアドバンスト・フォトンソース(APS)を利用し、新しい種類の医薬品を設計する方法を発見した。これらの医薬品は経口投与が可能で、「誤報」を遮断し、血栓症や癌など、これらの症状や他の症状への対処に役立つ可能性がある。
ティモシー・スプリンガー教授と、現在Morphic Therapeutic社の筆頭著者であるフーヤン・”アルバート”・リンが率いるハーバード大学の研究チームは、インテグリンという特殊な細胞表面受容体に着目しました。
スプリンガーは最近、インテグリンの機能の発見と特徴づけに貢献したとして、主要な医学賞であるラスカー賞を受賞している。
多発性硬化症などの自己免疫疾患では、根本的な感染がないにもかかわらずリガンドが出され、免疫反応とインテグリンの活性化の引き金となるのです」。研究者たちは、インテグリンの活性を効果的に抑制してリガンドと結合しないようにし、過剰に反応する免疫反応を防ぐ経口投与治療薬を見つけようと試みてきた。
研究者たちは、このようなことができる幅広いクラスの分子を見つけるために、10年以上にわたってAPSのGM/CAビームラインを使って、20種類以上の化合物によるインテグリンの結晶構造の特性評価を進めてきた。
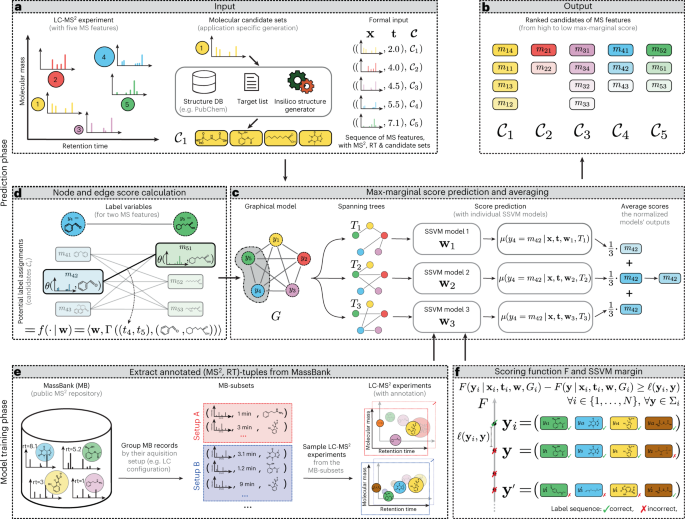
インテグリンは、結合する化合物の特性によって、開いた「オン」の位置と「オフ」の位置という2つの異なる構成をとることを発見した。インテグリンが「オン」の位置にあるとき、先発医薬品の作用の悪化に寄与している可能性が高い。
化合物がインテグリンをオフの状態に安定化させると、インテグリンの活性化を防ぐ水分子がしっかりと結合される。Springer助教は、この新しい化合物を「閉鎖安定化インテグリン阻害剤」と命名した。
この新しいタイプの分子は、リガンドとインテグリンの間に入り込み、結合のプロセスを妨害することによって作用する。同時に、インテグリン受容体の形状を「オフ」の状態に戻すのを助けるのだ。
この研究に基づく論文は、9月15日付の『Cell』誌に掲載された。
<関連情報>
- https://www.anl.gov/article/paving-the-way-for-new-drugs-to-treat-a-range-of-diseases
- https://www.sciencedirect.com/science/article/abs/pii/S0092867422009953
閉塞安定化インテグリン阻害剤を創製するための一般的な化学原理 A general chemical principle for creating closure-stabilizing integrin inhibitors
Fu-Yang Lin,JingLi,Yonghua Xie,Jianghai Zhu,Thi Thu Huong Nguyen,Yonghui Zhang,Jieqing Zhu,Timothy A.Springer
Cell Available online: 15 September 2022
DOI:https://doi.org/10.1016/j.cell.2022.08.008

Highlights
- •Integrin inhibitors in failed clinical trials stabilized the open conformation
- •Inhibitor designs that stabilize the closed integrin conformation were discovered
- •Inhibitor design principles were transferrable from integrin αIIbβ3 to α4β1
- •Closing inhibitors may lack the partial agonism seen with opening inhibitors
Summary
Integrins are validated drug targets with six approved therapeutics. However, small-molecule inhibitors to three integrins failed in late-stage clinical trials for chronic indications. Such unfavorable outcomes may in part be caused by partial agonism, i.e., the stabilization of the high-affinity, extended-open integrin conformation. Here, we show that the failed, small-molecule inhibitors of integrins αIIbβ3 and α4β1 stabilize the high-affinity conformation. Furthermore, we discovered a simple chemical feature present in multiple αIIbβ3 antagonists that stabilizes integrins in their bent-closed conformation. Closing inhibitors contain a polar nitrogen atom that stabilizes, via hydrogen bonds, a water molecule that intervenes between a serine residue and the metal in the metal-ion-dependent adhesion site (MIDAS). Expulsion of this water is a requisite for transition to the open conformation. This change in metal coordination is general to integrins, suggesting broad applicability of the drug-design principle to the integrin family, as validated with a distantly related integrin, α4β1.