国際共同研究により、小児てんかん発作の原因として、同一人物の細胞が異なる遺伝子を持つモザイク症が発見される International collaboration uncovers mosaicism, a condition in which cells within the same person have a different genetic makeup, as a cause for pediatric seizures
2023-01-12 カリフォルニア大学サンディエゴ校(UCSD)
Nature Genetics誌2023年1月12日号によると、カリフォルニア大学サンディエゴ校医学部とRady Children’s Institute for Genomic Medicineの研究者は、世界中の20以上の小児病院からなる国際コンソーシアムと共同で、MCDの遺伝的原因を理解する上で大きな進展があったと報告している。
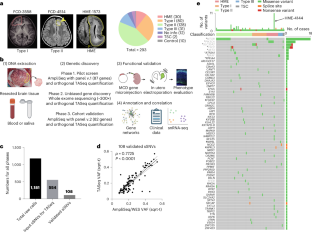
Focal Cortical Dysplasia Neurogenetics Consortiumのメンバーは、親の同意を得て、様々なタイプのMCDの子どもたちから採取した283個の脳切除片を調査し、遺伝的原因の可能性を探りました。 これらの小児の脳組織のほとんどは正常であるため、研究者たちは脳細胞のごく一部に存在する突然変異に焦点を当てました。この現象は遺伝的体細胞モザイクと呼ばれています。
カリフォルニア大学サンディエゴ校医学部のレディ神経科学教授で、レディ小児科ゲノム医学研究所の神経科学研究ディレクターのジョセフ・グリーソン医学博士は、「この研究のために、世界中の専門家を集め、10年にわたる旅でした」と述べています。「最近まで、ほとんどの病院では、切除された脳組織が遺伝的な原因によるものであるかどうかを調査することはありませんでした。コンソーシアムは、ハイスループットなモザイク解析のために、組織を保存するためのバイオバンクを組織しました。」Gleesonと同僚達による以前の研究は、mTORシグナル伝達経路の遺伝的体細胞モザイクが、一因であることを示していました、と共同筆頭著者であるGleeson研究室の博士研究員、Changuk Chung博士は言いました。「カリフォルニア大学サンディエゴ校が主導する国際コンソーシアムは、謎の多い小児てんかんの遺伝的要因の少なくとも一部を特定した。しかし、ほとんどの患者は診断されないままであり、それが治療の妨げになっています。私たちは、コホート規模を大幅に拡大し、方法を改善することによってのみ検出可能な隠れた変異を検査し、その結果を有意義なものにしました。技術的、物流的なボトルネックを解決するために、私たちは協力し合いました。しかし、10年かかりました」。
チームは、カリフォルニア大学サンディエゴ校がメンバーである、国立衛生研究所が後援する脳体細胞モザイクネットワークが開発した、最先端の体細胞モザイクアルゴリズムを使って、集中的にゲノム探索を行いました。
チームは、最終的に、69の異なる脳の体細胞変異を持つ遺伝子を同定しましたが、その大半は、MCDでこれまで報告されたことのないものでした。
グリーソン氏は、その遺伝子が、カルシウムシグナル伝達、遺伝子発現、シナプス機能に収束していることを発見し、その変異をマウスモデルに導入したところ、患者に見られるのと同様の異常が観察されたことに注目しています。この研究成果は、MCD疾患の診断の改善や治療法の開発に活用できる可能性があるとしている。
「患者の脳に存在するMCD遺伝子は、大脳皮質の発達において重要な役割を担っていることが明らかになっています」とGleesonは述べています。「これらの知見は、MCDの新しい分子分類につながり、最終的にはてんかんの個別化治療につながる可能性があります。
フル動画: https://youtu.be/XiEoTMunli4
<関連情報>
- https://today.ucsd.edu/story/study-identifies-cause-for-mysterious-cases-of-epilepsy-in-children
- https://www.nature.com/articles/s41588-022-01276-9
大脳皮質発達異常症における体細胞変異の包括的なマルチオミックスプロファイリング Comprehensive multi-omic profiling of somatic mutations in malformations of cortical development
Changuk Chung,Xiaoxu Yang,Taejeong Bae,Keng Ioi Vong,Swapnil Mittal,Catharina Donkels,H. Westley Phillips,Zhen Li,Ashley P. L. Marsh,Martin W. Breuss,Laurel L. Ball,Camila Araújo Bernardino Garcia,Renee D. George,Jing Gu,Mingchu Xu,Chelsea Barrows,Kiely N. James,Valentina Stanley,Anna S. Nidhiry,Sami Khoury,Gabrielle Howe,Emily Riley,Xin Xu,Brett Copeland,Yifan Wang,Se Hoon Kim,Hoon-Chul Kang,Andreas Schulze-Bonhage,Carola A. Haas,Horst Urbach,Marco Prinz,David D. Limbrick Jr.,Christina A. Gurnett,Matthew D. Smyth,Shifteh Sattar,Mark Nespeca,David D. Gonda,Katsumi Imai,Yukitoshi Takahashi,Hsin-Hung Chen,Jin-Wu Tsai,Valerio Conti,Renzo Guerrini,Orrin Devinsky,Wilson A. Silva Jr.,Helio R. Machado,Gary W. Mathern,Alexej Abyzov,Sara Baldassari,Stéphanie Baulac,Focal Cortical Dysplasia Neurogenetics Consortium,Brain Somatic Mosaicism Network & Joseph G. Gleeson
Nature Genetics Published:12 January 2023
DOI:https://doi.org/10.1038/s41588-022-01276-9
Abstract
Malformations of cortical development (MCD) are neurological conditions involving focal disruptions of cortical architecture and cellular organization that arise during embryogenesis, largely from somatic mosaic mutations, and cause intractable epilepsy. Identifying the genetic causes of MCD has been a challenge, as mutations remain at low allelic fractions in brain tissue resected to treat condition-related epilepsy. Here we report a genetic landscape from 283 brain resections, identifying 69 mutated genes through intensive profiling of somatic mutations, combining whole-exome and targeted-amplicon sequencing with functional validation including in utero electroporation of mice and single-nucleus RNA sequencing. Genotype–phenotype correlation analysis elucidated specific MCD gene sets associated with distinct pathophysiological and clinical phenotypes. The unique single-cell level spatiotemporal expression patterns of mutated genes in control and patient brains indicate critical roles in excitatory neurogenic pools during brain development and in promoting neuronal hyperexcitability after birth.


