カリフォルニア大学サンディエゴ校の研究者らが、膵臓がん幹細胞が、通常は腫瘍を抑制するタンパク質ファミリーのあるタンパク質を利用して、逆に従来の治療に対する抵抗性を高め、増殖を促進させることを説明 UC San Diego researchers describe how pancreatic cancer stem cells leverage a protein in a family of proteins that normally suppress tumors to instead do the opposite, boosting their resistance to conventional treatments and spurring growth
2023-01-19 カリフォルニア大学サンディエゴ校(UCSD)
◆カリフォルニア大学サンディエゴ校医学部とサンフォード再生医療コンソーシアムの研究者を中心とする国際研究チームは、最も耐性の高い膵臓がん細胞が、通常は腫瘍を抑制する可能性のあるタンパク質群を利用して、治療を回避してがん細胞がより速く増殖するのを助けることで、治療に抗することを明らかにした。
◆これまでの研究で、膵臓がんの治療抵抗性は、腫瘍細胞の不均一性(多様性)、特に治療抵抗性を促す幹細胞の特性によって、従来の薬剤に対する反応が異なることによって生じることが明らかになっています。
◆今回の研究では、カリフォルニア大学サンディエゴ校医学部の薬学・医学部教授およびがん生物学部長を歴任した筆頭著者Tannishtha Reya博士と同僚が、ゲノム変化(遺伝子そのものに特有の変化)ではなく、エピジェノミクス(ゲノムに何をすべきかを伝える多数のタンパク質)変化がどのように耐性をもたらすかを調べました。
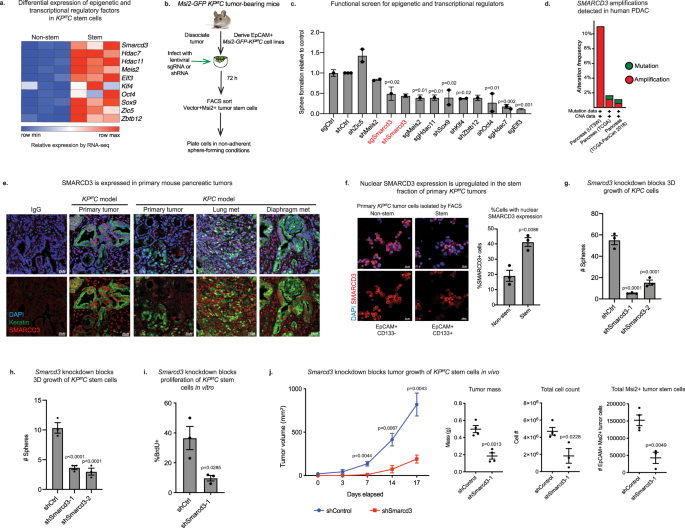
◆レヤと同僚達は、クロマチンを制御するSWI/SNFファミリーのメンバーで、染色体を形成するDNAとタンパク質の混合物で、発生における幹細胞の機能に必要なSMARCD3に焦点を当てました。SWI-SNFサブユニットはしばしば腫瘍抑制因子として働く。研究チームは、SMARCD3ががんにおいて増幅され、特に膵臓がん幹細胞に豊富に存在し、ヒトの病気では発現が上昇または増加することを見いだした。そして、膵臓がんモデルでSMARCD3を欠失させると、このタンパク質の消失によって腫瘍の成長が抑えられ、特に化学療法を行った場合に生存率が向上した。
◆「重要なことは、SMARCD3が、がんの治療抵抗性や予後不良に関連する脂質や脂肪酸の代謝を制御していることを見出したことです」と、レヤ副センター長は述べた。「私たちのデータは、治療抵抗性の膵臓がん細胞が、抗がん剤治療を回避して活発に増殖できるような代謝環境を確保するために、SMARCD3が必要であることを示唆しています。このことから、SMARCD3は治療薬として期待できる新しい標的であると言えます。
<関連情報>
- https://today.ucsd.edu/story/how-pancreatic-cancer-defies-treatment
- https://www.nature.com/articles/s41467-023-35796-7#Ack1
Smarcd3は膵管腺癌における代謝風景のエピジェネティックモデュレーターである Smarcd3 is an epigenetic modulator of the metabolic landscape in pancreatic ductal adenocarcinoma Published:18 January 2023 DOI:https://doi.org/10.1038/s41467-023-35796-7
L. Paige Ferguson,Jovylyn Gatchalian,Matthew L. McDermott,Mari Nakamura,Kendall Chambers,Nirakar Rajbhandari,Nikki K. Lytle,Sara Brin Rosenthal,Michael Hamilton,Sonia Albini,Martin Wartenberg,Inti Zlobec,José A. Galván,Eva Karamitopoulou,Vera Vavinskaya,Alexis Wascher,Andrew M. Lowy,Christian M. Schürch,Pier Lorenzo Puri,Benoit G. Bruneau,Diana C. Hargreaves & Tannishtha Reya
Nature Communications
Abstract
Pancreatic cancer is characterized by extensive resistance to conventional therapies, making clinical management a challenge. Here we map the epigenetic dependencies of cancer stem cells, cells that preferentially evade therapy and drive progression, and identify SWI/SNF complex member SMARCD3 as a regulator of pancreatic cancer cells. Although SWI/SNF subunits often act as tumor suppressors, we show that SMARCD3 is amplified in cancer, enriched in pancreatic cancer stem cells and upregulated in the human disease. Diverse genetic mouse models of pancreatic cancer and stage-specific Smarcd3 deletion reveal that Smarcd3 loss preferentially impacts established tumors, improving survival especially in context of chemotherapy. Mechanistically, SMARCD3 acts with FOXA1 to control lipid and fatty acid metabolism, programs associated with therapy resistance and poor prognosis in cancer. These data identify SMARCD3 as an epigenetic modulator responsible for establishing the metabolic landscape in aggressive pancreatic cancer cells and a potential target for new therapies.