グリオブラストーマのマウスで免疫抑制細胞をブロックすると生存率が向上した Blocking immune suppressor cells in mice with glioblastoma improved survival
2023-01-27 ワシントン大学セントルイス校
GETTY IMAGES
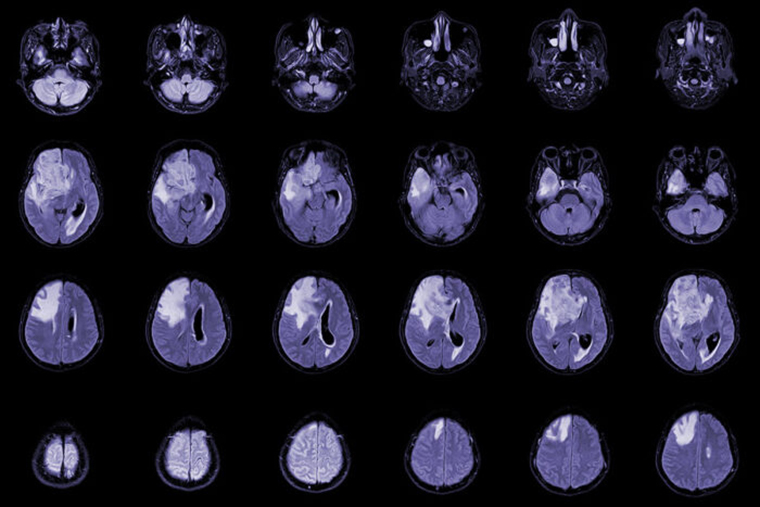
A new study led by Washington University School of Medicine in St. Louis reveals at least one cause of low white blood cell counts in patients treated for glioblastoma and demonstrates a potential treatment strategy that improves survival in mice. Shown are MRI scans of a patient with this type of brain tumor.
◆セントルイスのワシントン大学医学部が主導する新しい研究は、膠芽腫の治療を受けた患者の白血球数が少なくなる少なくとも1つの原因を明らかにし、マウスで生存率を向上させる治療戦略の可能性を実証しています。この研究は、Science Translational Medicine誌に掲載されています。
◆このがんの患者さんは通常、18カ月以上生存することはできません。標準的な治療法は放射線療法と化学療法ですが、その後、多くの患者は血流中の白血球の一種であるリンパ球の数が著しく低下するようになります。この治療法は、リンパ球の発生源である骨髄を標的にしないため、すべての患者がこの問題を経験するわけではないので、このリンパ球数の減少の原因は謎のままでした。
◆サイトマンのHuangと彼の同僚達は、膠芽腫患者から血液サンプルを集めて分析する研究を主導しました。患者の約半数は、治療後に白血球数が低下していた。
◆研究者らは、白血球数が低下した患者において、骨髄由来抑制細胞と呼ばれる、免疫系を抑制することで知られる種類の細胞が有意に増加していることを発見した。そして、マウスを使った実験で、腫瘍への放射線照射によって増加した骨髄由来抑制細胞と白血球の抑制の間に因果関係があることを突き止めた。
◆ワシントン大学でこの研究を行い、現在はオクラホマ大学健康科学センターに勤務する筆頭共同研究者のディネシュ・トタラ博士は、「我々は、阻害剤を用いてこれらの骨髄系抑制細胞をブロックし、放射線治療に対する反応を改善できるかどうかを調べたいと思いました」と述べています。”我々は、最終的に、2つの阻害剤を別々に放射線でテストして、この癌の複数のマウスモデルで、生存率が大幅に改善することを発見しました。”
◆最初はワシントン大学で、今はオクラホマ大学で、トタラの研究室でこの研究を行った博士研究員の筆頭著者スバジット・ゴッシュ博士を含む研究者達は、平均して、放射線だけを受けたグリオブラストーマのマウスは全て40日目までに死んでしまうことを発見しました。一方、阻害剤と放射線を併用したマウスでは、実験終了の120日目には50%から60%が生存していた。
◆CB1158という阻害剤の1つは、アルギナーゼ1阻害剤と呼ばれる種類の薬剤で、大腸がん、肺がん、膀胱がんなどの固形腫瘍の治療薬として臨床試験が行われているものである。2つ目の薬剤は、タダラフィルと呼ばれるホスホジエステラーゼ5阻害剤で、勃起不全や肺高血圧症など他の疾患の治療薬として食品医薬品局から承認されています。
◆研究者達は、彼らの発見をさらに確認するために、膠芽腫の患者に対して、タダラフィルと標準的な放射線を併用する小規模臨床試験を実施しました。研究者らによると、一部の患者はこの治験的治療に対して良好な反応を示し、有望な結果が得られているとのことです。この研究は、現在、別の科学雑誌で審査中である。また、研究者らは、骨髄由来抑制細胞を阻害するこれら2つの阻害剤よりもさらに可能性のある新しい治療法の開発に向けて取り組んでいる。
<関連情報>
- https://source.wustl.edu/2023/01/patients-with-brain-cancer-may-benefit-from-treatment-to-boost-white-blood-cells/
- https://medicine.wustl.edu/news/patients-with-brain-cancer-may-benefit-from-treatment-to-boost-white-blood-cells/
- https://www.science.org/doi/10.1126/scitranslmed.abn6758
放射線誘発性循環骨髄由来抑制細胞による膠芽腫患者における化学放射線療法後の全身性リンパ球減少の誘発 Radiation-induced circulating myeloid-derived suppressor cells induce systemic lymphopenia after chemoradiotherapy in patients with glioblastoma
Subhajit Ghosh ,Jiayi Huang ,Matthew Inkman ,Jin Zhang ,Sukrutha Thotala,Ekaterina Tikhonova ,Natalia Miheecheva ,Felix Frenkel ,Ravshan Ataullakhanov ,Xiaowei Wang ,David DeNardo ,Dennis Hallahan,Dinesh Thotala
Science Translational Medicine Published:25 Jan 2023
DOI: 10.1126/scitranslmed.abn6758
Abstract
Severe and prolonged lymphopenia frequently occurs in patients with glioblastoma after standard chemoradiotherapy and has been associated with worse survival, but its underlying biological mechanism is not well understood. To address this, we performed a correlative study in which we collected and analyzed peripheral blood of patients with glioblastoma (n = 20) receiving chemoradiotherapy using genomic and immune monitoring technologies. RNA sequencing analysis of the peripheral blood mononuclear cells (PBMC) showed an elevated concentration of myeloid-derived suppressor cell (MDSC) regulatory genes in patients with lymphopenia when compared with patients without lymphopenia after chemoradiotherapy. Additional analysis including flow cytometry and single-cell RNA sequencing further confirmed increased numbers of circulating MDSC in patients with lymphopenia when compared with patients without lymphopenia after chemoradiotherapy. Preclinical murine models were also established and demonstrated a causal relationship between radiation-induced MDSC and systemic lymphopenia using transfusion and depletion experiments. Pharmacological inhibition of MDSC using an arginase-1 inhibitor (CB1158) or phosphodiesterase-5 inhibitor (tadalafil) during radiation therapy (RT) successfully abrogated radiation-induced lymphopenia and improved survival in the preclinical models. CB1158 and tadalafil are promising drugs in reducing radiation-induced lymphopenia in patients with glioblastoma. These results demonstrate the promise of using these classes of drugs to reduce treatment-related lymphopenia and immunosuppression.