2023-02-02 スウェーデン王国・チャルマース工科大学
◆「細胞に影響を与えるものを加える必要がなく、ナノレベルで独自の精度を出すことができます。現在使われている同等の方法では不可能なことです」と、インフラのディレクターであり、チャルマース工科大学化学・化学工学部の上級研究員であるペール・マルンベルグ氏は言う。
◆ヒトゲノムの包括的な知識のおかげで、研究者は、細胞内部の特定のターゲットに作用する、より効果的な薬剤を設計することができます。この進歩により、薬物設計者は、その分子が細胞内でどのように振る舞うかを考慮する必要が出てきたのです。
◆ケミカル・イメージング・インフラストラクチャーのパートナーによって開発されたこの新しい方法は、最近発表されたホワイトペーパーで説明されています。この方法では、ペプチドやオリゴヌクレオチドなどの生物学的医薬品をヒト細胞内で高い信頼性をもって分析・定量化するための最先端の技術や知識が強化されています。
◆新手法は、CAMECAが開発したナノスケールで分子を高解像度で測定・画像化できる装置「NanoSIMS(ナノスケール二次イオン質量分析)」をベースに、2015年から化学イメージング基盤で利用できるようにしたものである。この装置は科学界で広く研究に採用されていますが、まだ医薬品の開発には適用されていません。
◆これまでのところ、研究者たちは培養細胞を用いて研究を行っているが、この技術は組織の検査にも用いることができる。長期的には、薬剤の作用が期待される臓器の個々の細胞で何が起こっているかを調べるのにも使えるだろう。これは、例えばALSやパーキンソン病などの神経変性疾患や、がんをより深く理解するための鍵となるかもしれません。
◆製薬業界では、薬物分子とその細胞内分布をナノスケールで定量化する方法論の開発と応用が大きな課題となっています。「細胞内の薬物のイメージングに成功したことは、非常に喜ばしいことです。薬物が細胞内に入ると、さまざまなことが起こります。今回初めてこのレベルでの観察が可能になったことで、これまで治療ができなかった病気の治療薬を設計するのに役立つ重要な情報を得ることができます」と、アストラゼネカのアソシエイト・プリンシパル・サイエンティスト、マイケル・クルツィは述べています。
<関連情報>
- https://news.cision.com/chalmers/r/new-method-reveals-nano-scale-drug-molecules-in-cells,c3707022
- https://pubs.acs.org/doi/10.1021/acs.analchem.2c02111
- https://pubs.acs.org/doi/10.1021/acsnano.9b09804
NanoSIMSによるオリゴヌクレオチド治療薬の細胞内絶対定量化 Intracellular Absolute Quantification of Oligonucleotide Therapeutics by NanoSIMS
Cécile Becquart, Rouven Stulz, Aurélien Thomen, Maryam Dost, Neda Najafinobar, Anders Dahlén, Shalini Andersson, Andrew G. Ewing and Michael E. Kurczy
Analytical Chemistry Published:July 13, 2022
DOI:https://doi.org/10.1021/acs.analchem.2c02111
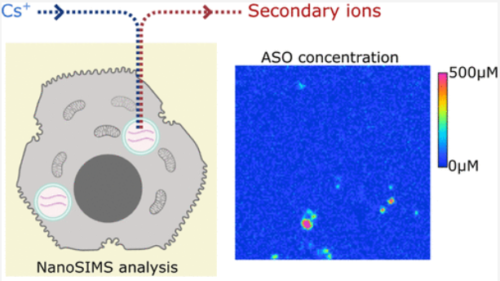
Abstract
Antisense oligonucleotide (ASO)-based therapeutics hold great potential for the treatment of a variety of diseases. Therefore, a better understanding of cellular delivery, uptake, and trafficking mechanisms of ASOs is highly important for early-stage drug discovery. In particular, understanding the biodistribution and quantifying the abundance of ASOs at the subcellular level are needed to fully characterize their activity. Here, we used a combination of electron microscopy and NanoSIMS to assess the subcellular concentrations of a 34S-labeled GalNAc-ASO and a naked ASO in the organelles of primary human hepatocytes. We first cross-validated the method by including a 127I-labeled ASO, finding that the absolute concentration of the lysosomal ASO using two independent labeling strategies gave matching results, demonstrating the strength of our approach. This work also describes the preparation of external standards for absolute quantification by NanoSIMS. For both the 34S and 127I approaches used for our quantification methodology, we established the limit of detection (5 and 2 μM, respectively) and the lower limit of quantification (14 and 5 μM, respectively).
細胞内質量分析イメージングと小器官を横断する絶対定量分析 Subcellular Mass Spectrometry Imaging and Absolute Quantitative Analysis across Organelles
Aurélien Thomen, Neda Najafinobar, Florent Penen, Emma Kay, Pratik P. Upadhyay, Xianchan Li, Nhu T. N. Phan, Per Malmberg, Magnus Klarqvist, Shalini Andersson, Michael E. Kurczy and Andrew G. Ewing
ACS Nano Published:April 2, 2020
DOI:https://doi.org/10.1021/acsnano.9b09804
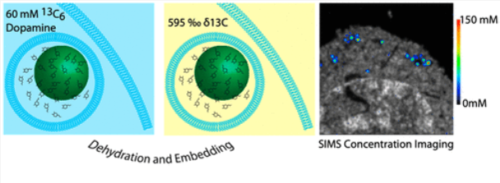
Abstract
Mass spectrometry imaging is a field that promises to become a mainstream bioanalysis technology by allowing the combination of single-cell imaging and subcellular quantitative analysis. The frontier of single-cell imaging has advanced to the point where it is now possible to compare the chemical contents of individual organelles in terms of raw or normalized ion signal. However, to realize the full potential of this technology, it is necessary to move beyond this concept of relative quantification. Here we present a nanoSIMS imaging method that directly measures the absolute concentration of an organelle-associated, isotopically labeled, pro-drug directly from a mass spectrometry image. This is validated with a recently developed nanoelectrochemistry method for single organelles. We establish a limit of detection based on the number of isotopic labels used and the volume of the organelle of interest, also offering this calculation as a web application. This approach allows subcellular quantification of drugs and metabolites, an overarching and previously unmet goal in cell science and pharmaceutical development.