2022-08-09 東京大学
小林 和弘(生物科学専攻 博士課程)
川上 耕季(東北大学大学院薬学研究科 助教)
草木迫 司(生物科学専攻 助教)
加藤 英明(東京大学大学院総合文化研究科/先進科学研究機構 兼 生物科学専攻 准教授)
井上 飛鳥(東北大学大学院薬学研究科 教授)
濡木 理(生物科学専攻 教授)
発表のポイント
- クライオ電子顕微鏡を用いて、骨代謝において中心的な役割を果たす副甲状腺ホルモン1型受容体(PTH1受容体)について、作用の異なる2 つのホルモン分子(副甲状ホルモン(PTH)と副甲状腺ホルモン関連ペプチド(PTHrP))が結合したシグナル伝達複合体構造を可視化しました。
- PTHとPTHrPが異なる様式で受容体に結合することを見出し、生理的応答の違いを規定する構造基盤を明らかにしました。
- PTH1受容体からPTHが脱離する過程の連続した構造変化を明らかにし、PTH1受容体の活性化サイクルを提唱しました。
発表概要
骨はヒトにおいて必須の臓器の1つであり、骨格の維持や臓器の保護、血中カルシウム濃度の調節など多くの役割を担います。PTH(注1)およびPTHrP (注2)は、骨の形成から維持までのあらゆる過程における最重なペプチドであり、その機能はPTH1受容体 (注3)と、Gタンパク質三量体(注4)の1つである刺激性Gタンパク質(Gsタンパク質)三量体を活性化することにより発揮されます。PTHとPTHrPはともに骨形成を促進することから、骨粗しょう症の治療薬として着目されている一方で、これらのホルモンはPTH1受容体を介して過剰なシグナルを伝達し、骨破壊をも促進するという副作用が知られています。PTHとPTHrPでは副作用の程度が異なることから、これらのホルモンによる作用機序の違いを理解することにより、副作用の低減された薬剤の創出が期待されています。しかし、これらのホルモンによりPTH1受容体が活性化される構造的なメカニズムは不明であり、副作用を生み出すメカニズムは明らかになっていませんでした。
今回、東京大学大学院理学系研究科の濡木理教授らのグループは、クライオ電子顕微鏡による単粒子構造解析法 (注5) によりPTHおよびPTHrPと結合したPTH1受容体とGsタンパク質三量体で構成されるシグナル伝達複合体の立体構造を解明しました。PTH結合型PTH1受容体とPTHrP結合型PTH1受容体の構造比較から、2つのホルモンはPTH1受容体とそれぞれ異なる相互作用を形成することが明らかになり、東北大学大学院薬学研究科の井上飛鳥教授との共同研究により、PTHとPTHrPがPTH1受容体を活性化する際に重要な相互作用を特定しました。加えて、2つのホルモンの相互作用の違いから、副作用を発現するメカニズムを明らかにしました。
また、PTH結合型PTH1受容体とGsタンパク質複合体の試料からは計5種類の異なる状態の立体構造が得られ、計算機シミュレーション解析から、これらの構造状態はPTHが受容体から脱離する過程の構造変化を表していることを明らかにしました。
この研究成果により、PTHとPTHrPによる生理的応答の違いを規定する構造基盤の理解が深まり、副作用の少ない骨粗しょう症治療薬の開発が促進されることが期待されます。
発表内容
研究の背景・先行研究における問題点
Gタンパク質共役型受容体(GPCR, (注6) )は、ヒトにおける最大のファミリーを形成するタンパク質であり、約800種存在するGPCRがヒトの大半の生理現象を制御しています。本研究の研究対象であるPTH1受容体は、骨代謝における最重要因子の1つとして知られています。PTH1受容体は2つの内在性リガンド(注7)であるPTHおよびPTHrPと結合することで活性型へと構造変化を生じ、活性化したPTH1受容体は骨形成を誘導します。このような骨形成作用から、これらのリガンドやその改変型リガンドが骨粗しょう症の主要な治療薬として用いられています。しかし、これらの薬剤は副作用として骨破壊も誘導するため、副作用の少ない新たな骨粗しょう症治療薬の探索が続いています。特に、PTHrPはPTHよりも副作用発現の程度が低いことが特徴であり、PTHやPTHrPによる副作用は受容体の活性化する時間の長さと相関があることが報告されております。そのため、PTHとPTHrPと結合したPTH1受容体の立体構造を用いて受容体の活性化時間を制御するメカニズムを解明することにより、副作用の少ない骨粗しょう症治療薬の開発が待ち望まれています。しかし、これらのリガンドにより活性化したPTH1受容体の立体構造は明らかになっておらず、受容体活性化時間の制御機構を突き止めることは困難でした。
研究内容
今回、東京大学大学院理学系研究科の小林和弘博士課程学生、草木迫司助教、加藤英明准教授、濡木理教授らの研究グループは、クライオ電子顕微鏡を用いた単粒子解析により、PTHもしくはPTHrPと結合したPTH1受容体とGsタンパク質三量体との活性化型複合体の立体構造を解明しました(図1)。PTHはそのC末端でPTH1受容体の細胞外ドメイン (注8) と、そのN末端でPTH1受容体の膜貫通ドメイン(注9)と結合し、これらの相互作用により、リガンドのほぼ全長が安定したヘリックス構造を形成していました。

図1:PTH1受容体のシグナル伝達複合体の全体構造
PTH結合型PTH1受容体とGsタンパク質(左図)、PTHrP結合型PTH1受容体とGsタンパク質(右図)のシグナル伝達複合体の全体構造を表している。Gsタンパク質はGαs, Gβ1, Gγ2の三量体から構成されており、今回の研究ではGαsには熱安定型変異体であるmini Gαsを用いることで構造決定に成功した。また、シグナル伝達複合体の安定性を向上させるために、複合体構造を認識する抗体、Nb35を用いている。
PTHとPTHrPはPTH1受容体の膜貫通ドメインと広範な親水性相互作用を形成しており、変異体解析によりこれらの相互作用が受容体の活性化に必須であることが明らかになりました(図2, 3)。また、これらのリガンドは受容体の3番目と5番目の膜貫通ヘリックス(TM3と TM5)の間に形成される疎水性ポケットと特徴的な相互作用を形成しており(図2)、PTHはこのポケットと密接な相互作用を形成している一方で、PTHrPは疎水性ポケットと結合する位置に存在するアミノ酸がPTHと異なっており、この疎水性ポケットと十分な結合を形成していないことが明らかになりました(図3)。クライオ電子顕微鏡で観察されたPTH1R受容体とリガンドの特定の相互作用の重要性について、東北大学大学院薬学研究科の川上耕季助教、井上飛鳥教授は培養細胞におけるPTH1R変異体のシグナル活性を解析することで実証しました。これらのリガンドは活性化状態においてのみこの疎水性ポケットと結合することから、PTHは受容体を活性化状態に保つ作用が強い一方で、PTHrPは受容体を活性化状態に保つ作用が弱いことが示唆されました。
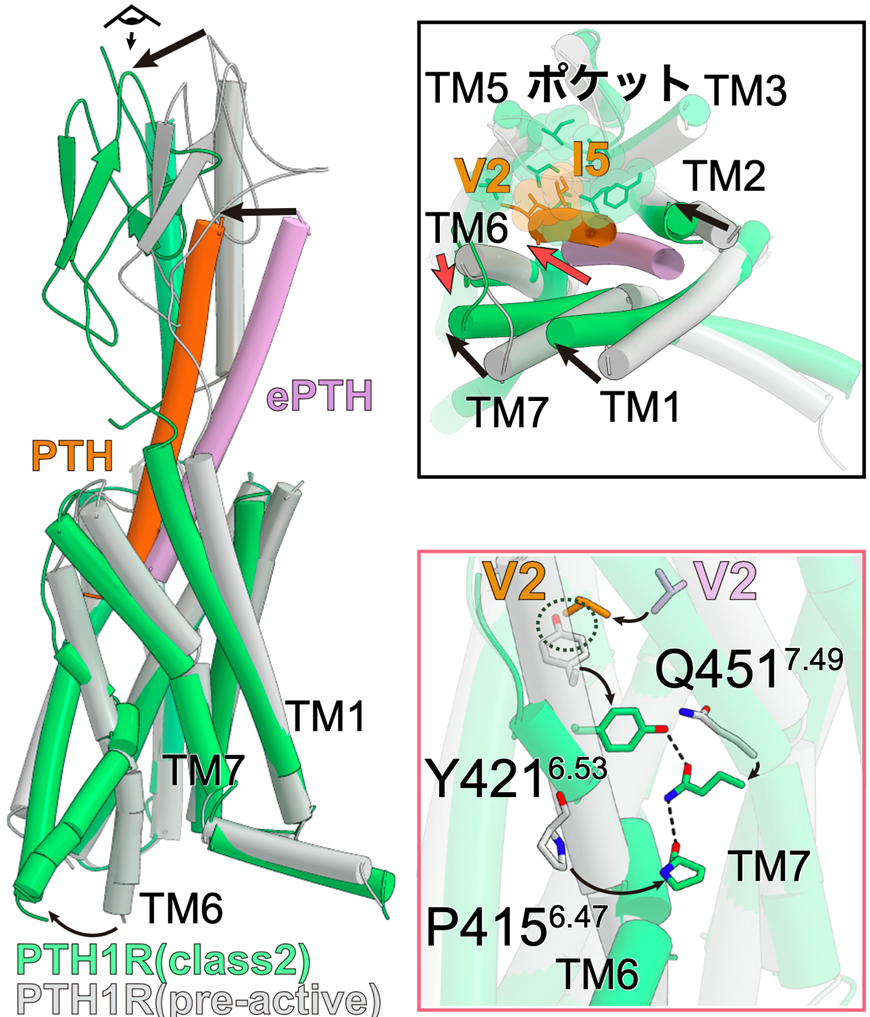
図2:ePTH結合型不活性化PTH1受容体とPTH結合型活性化型PTH1受容体
活性化前のPTH1受容体と活性化PTH結合型PTH1受容体とを比較すると、活性化構造ではTM6の細胞内側が大きく構造変化しており、Gタンパク質の結合する空間を生み出していた(左図)。受容体を細胞外側から見ると、活性化に伴い受容体のTM1, 2, 7がTM5に向かって構造変化し、TM6が受容体外側に構造変化している(右上図)。活性化に伴うTM6の構造変化とそれを安定化するYQPモチーフ(Y421, Q451, P415から成る)が形成されている(右下図)。

図3:PTH1受容体の活性化に関わるリガンド相互作用
PTH結合型PTH1受容体とPTHrP結合型PTH1受容体の重ね合せ図(左図)。目の図と矢印はどこから見た図かを表しており、右の図にそれぞれ対応する。
左がPTH(オレンジ)とPTH1受容体(緑色)、右がPTHrP(水色)とPTH1受容体(青色)の相互作用。第3膜貫通ヘリックス(TM3)とTM5に形成されている疎水性ポケットに対し、リガンドの2残基目と5残基目が相互作用している。PTHでは5残基目がイソロイシンであり疎水性ポケット全体と密接に相互作用している一方で、PTHrPでは5残基目がヒスチジンであるため疎水性ポケットの一部のみとしか相互作用できなくなっている。
また、PTH結合型PTH1受容体の構造解析からは、リガンド脱離過程における5つの異なる構造が明らかになりました(図4)。得られた構造と計算機シミュレーションから、PTHにより活性化されたPTH1受容体が不活性化する際には、リガンドの17番目のアミノ酸残基を起点としてリガンドのヘリックス構造が失われることが引き金となり、続いてPTHリガンドと受容体の疎水性ポケット間の相互作用が失われるという一連の構造変化が明らかになりました。この構造変化の理解は、特定のリガンドのアミノ酸残基と受容体の結合を調節することで受容体の活性化時間を制御し、副作用を低減させた薬剤を開発することに貢献します。
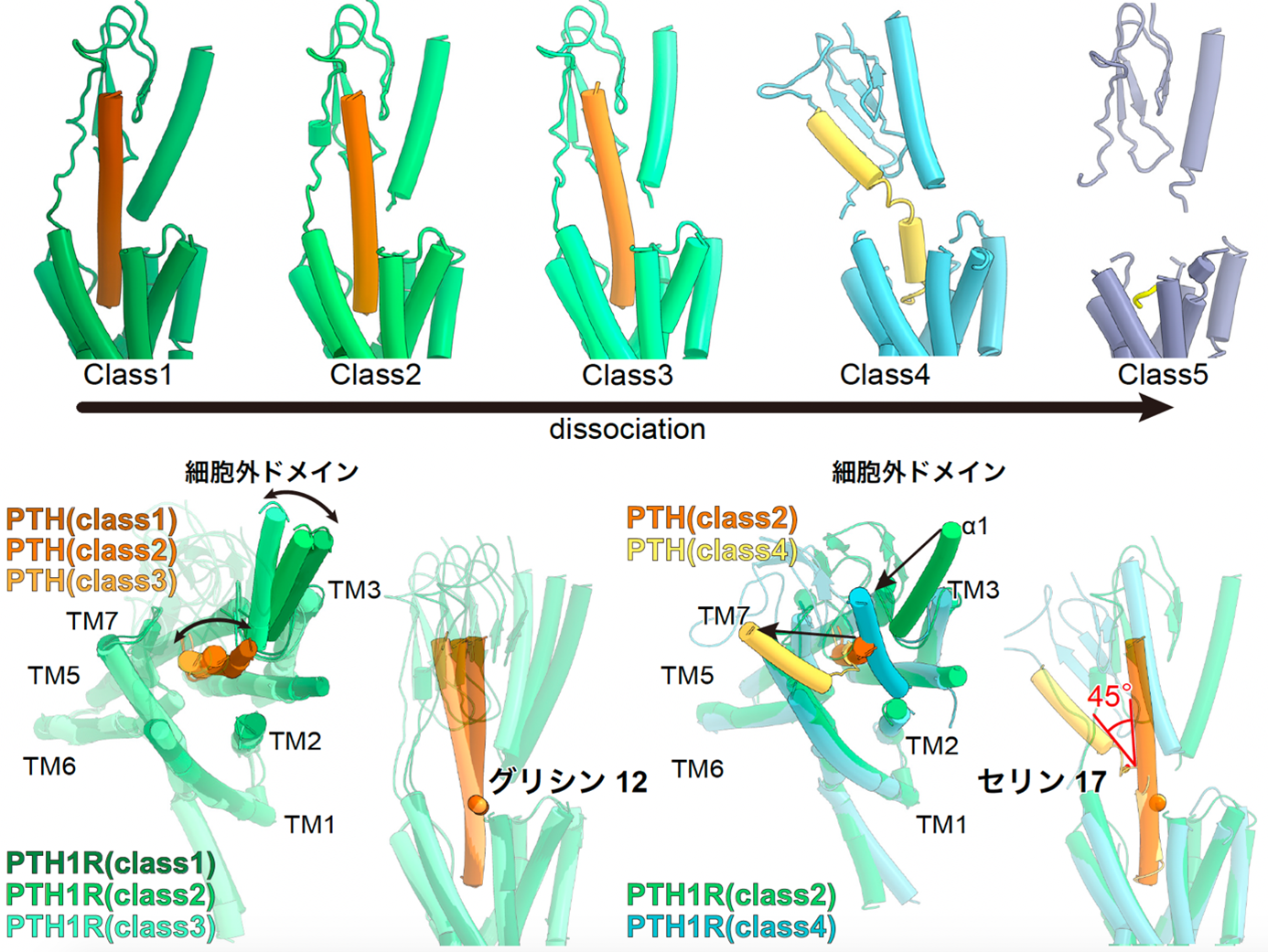
図4:PTH結合型PTH1受容体とGsタンパク質複合体の5つの異なる構造
PTH結合型PTH1受容体とGsタンパク質複合体からはPTHの脱離過程を捉えた5つの構造が明らかになった(上図)。Class 1, 2, 3ではPTHのほぼ全長がヘリックス構造をとっており、12残基目のグリシンを起点に、細胞外ドメインとPTHが共同して構造変化していた(左下図)。その一方で、Class 4ではPTHが17残基目のセリンで約45度の大きな折れ曲がりを示しており、Class 5では受容体の活性化に必須なN末端の5残基を除いて、PTHは強固な構造を取っていなかった。
加えて、これらの構造からは、細胞外領域の構造が不安定化することによりPTH1受容体はGsタンパク質との特徴的な相互作用を失うことが明らかになりました(図5)。これらの結果はPTH1受容体を介した副作用メカニズムの構造基盤を明らかにすると共に、世界で初めてGPCRからリガンドが脱離する過程の構造変化を実験的に捉えたものです。

図5:PTHリガンドの連続した構造変化とPTH1受容体Gタンパク質界面の相互作用の遷移
本研究により明らかになった複数の構造から、PTHリガンドの構造変化(左図: 焦げ茶色→黄色)に応じて、PTH1受容体とGタンパク質の特徴的な相互作用が失われる(右上図: 緑色→紫色、 右下図: 黄色→赤色)ことが明らかになった。
社会的意義・今後の予定
本研究は、立体構造解析、計算機シミュレーション、培養細胞を用いた機能解析を組み合わせることで、PTH1Rを介した副作用発現メカニズムとリガンドの連続的な脱離過程を明らかにしました。本研究の結果からは副作用を低減した骨粗しょう症治療薬の合理的な設計に役立つことが期待されます。
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(研究代表者:濡木理)をはじめとする科学研究費助成事業(課題番号: 16H06294, 19H03163, 20J21820, 21H05142, 21H04791, 21H05113, JPJSBP120213501, JPJSBP120218801)、および、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)(JP20am0101095)、革新的先端研究開発支援事業ソロタイプ(PRIME)(JP19gm5910013)、革新的先端研究開発支援事業インキュベートタイプ(LEAP)(JP20gm0010004)、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業さきがけ(JPMJPR1331)およびムーンショット型研究開発事業(JPMJMS2023)、武田科学振興財団、アステラス病態代謝研究会、花王芸術科学財団、持田記念医学薬学振興財団、東京生化学研究会、第一三共生命科学研究振興財団、上原記念生命科学財団など多くの支援を受けて行われました。
発表雑誌
- 雑誌名
Molecular Cell論文タイトル
Endogenous ligand recognition and structural transition of a human PTH receptor著者
Kazuhiro Kobayashi(1), Kouki Kawakami(2), Tsukasa Kusakizako(1), Hirotake Miyauchi(1), Atsuhiro Tomita(1), Kan Kobayashi(1), Wataru Shihoya(1), Keitaro Yamashita(1, 3), Tomohiro Nishizawa(1, 4), Hideaki E. Kato(1, 5),*, Asuka Inoue(2),*, Osamu Nureki(1)*.
*共同責任著者 (1) 東京大学大学院理学系研究科生物科学専攻 (2) 東北大学大学院薬学研究科分子細胞生物学分野 (3) MRC研究所 (4) 横浜市立大学大学院生命医科学研究科 (5) 東京大学大学院総合文化研究科広域科学専攻
用語解説
注1 副甲状腺ホルモン(PTH)
PTHは副甲状腺から放出される84アミノ酸の直鎖ペプチド(PTH(1-84))であり、主にPTH1受容体を活性化するペプチドホルモンである。特にN末端の34残基(PTH(1-34)、 テリパラチド)がPTH1受容体の活性化に必須であることが明らかになっており、このテリパラチドは骨粗しょう症に対する臨床治療薬として活用されている。PTHは強い骨形成作用を示す一方で、非常に長いPTH1受容体の活性化を介して骨を破壊する副作用が知られており、受容体の活性化時間を制御することにより、副作用の低減されたPTH改変体の開発が期待されている。
注2 副甲状腺ホルモン関連ホルモン(PTHrP)
PTHrPは内分泌腺、血管、膀胱平滑筋、子宮平滑筋、乳腺、表皮、中枢神経系など多様な細胞から分泌される141アミノ酸の直鎖ペプチドであり、PTH1受容体を選択的に活性化するペプチドホルモンである。特にN末端の36残基(PTHrP(1-36))がPTH1受容体の活性化に必須であることが明らかになっている。このPTHrP(1-36)はPTHと比べて弱い骨形成作用を持つものの、非常に短い受容体の活性化を誘導するため副作用である骨破壊作用も低減されている。そのため、この短い受容体活性化のメカニズムが明らかになることにより、PTHリガンドの副作用低減に向けた具体的な指針が明らかになることが期待されている。
注3 副甲状腺ホルモン1型(PTH1)受容体
PTH1受容体は2つの内在性ホルモンであるPTHとPTHrPにより活性化し、骨の形成から維持までに必須の役割を果たすGタンパク質共役型受容体である。PTH1受容体は骨の形成と破壊、そしてそれに伴う体内のカルシウム恒常性を制御していることから、PTH1受容体を標的とした医薬品開発は急性カルシウム血症、副甲状腺機能低下症、骨粗しょう症といったさまざまな疾患の治療が可能となることが期待されている。特に、PTH投与によるPTH1受容体の活性化は骨粗しょう症を有意に回復させることから、PTHやPTHrPを改変した骨粗しょう症治療薬開発が進められてきた。
注4 Gタンパク質三量体
細胞内情報伝達に関わるGTP結合タンパク質であり、Gα、G β、Gγサブユニットの三量体により構成されている。Gタンパク質三量体は作動薬の結合したGPCRによって活性化され、活性化されたGタンパク質はGDP-GTP交換反応を伴ってGαとGβ-Gγの2つに解離する。解離した各サブユニットはそれぞれ異なる下流のシグナル伝達因子と結合し、そのシグナル伝達因子を活性化することで、細胞内においてさまざまなシグナル応答を生じる。
注5 クライオ電子顕微鏡を用いた単粒子解析法
電子顕微鏡を用いてタンパク質を始めとした多数の生体高分子の像を撮影し、これらの画像を重ね合わせることによりその立体構造を再構成、生体高分子の立体構造を決定する手法である。この手法では液体窒素(-196℃)等により極低温に冷却された試料に対して電子線を照射し、資料を透過した電子線を検出することにより試料の観察を行う。ここ10年間で試料の測定方法や検出器などが目覚ましい技術革新を遂げており、タンパク質の立体構造を高分解能で決定する手法として広く知られてきた。この技術革新の功績から、その開発に貢献した海外の研究者3名に対し、2017年度のノーベル化学賞が贈られた。
注6 Gタンパク質共役型受容体(GPCR)
GPCRは細胞膜に発現する7回膜貫通型タンパク質であり、最大のファミリー(ヒトでは約800種)を形成するタンパク質として知られている。GPCRは細胞外の特定の結合因子(リガンド)のみにより活性化し、膜貫通部位の構造変化により細胞内のGタンパク質三量体を活性化可能な状態になる。特定のリガンドのみが結合できるように進化した各受容体により、実質的にヒトのほぼ全ての生命現象が制御されることが知られており、GPCRを標的とした薬剤は既承認医薬品の30%以上を占めている。本研究の対象であるクラスB1のGPCRは細胞外ドメインと膜貫通ドメインの2つのドメインから構成され、ペプチドホルモンを受容するグループである。
注7 リガンド
リガンドとは機能をもつタンパク質に特異的に結合する物質であり、標的タンパク質に結合することで標的タンパク質の立体構造を変化させる。リガンドと標的タンパク質はいわば鍵穴と鍵の関係にあり、鍵であるリガンドが標的の鍵穴へと特異的に結合する。
注8 細胞外ドメイン
クラスB1 GPCRに共通した120〜160アミノ酸で構成される細胞外領域に存在するドメインである。クラスB1 GPCRのリガンドである長いペプチドホルモンを受容するために機能していると考えられており、受容体によりその詳細な機能が異なっている。
注9 膜貫通ドメイン
GPCRに特徴的な7回の膜貫通ヘリックスからなるドメインで、作動薬が結合することにより6番目の膜貫通ヘリックスが大きく外側に構造変化し、細胞内にGタンパク質三量体が結合可能となる。