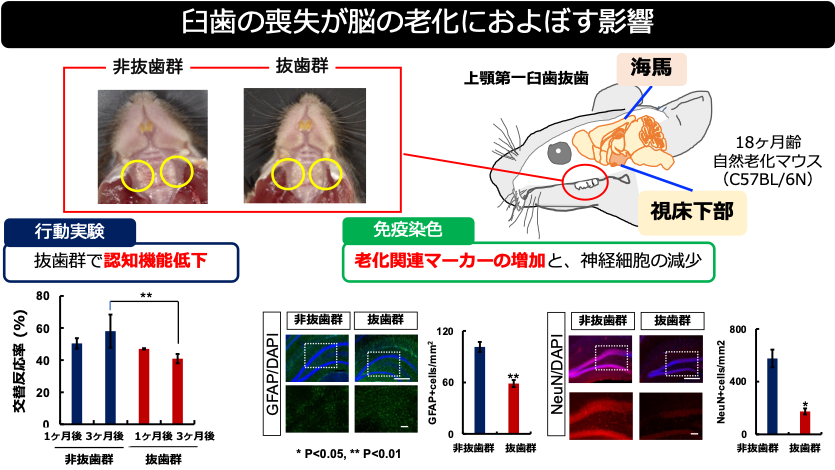
2022-04-26 理化学研究所,東北大学,北里大学,花王株式会社
理化学研究所(理研)脳神経科学研究センター細胞機能探索技術研究チームおよび光量子工学研究センター生命光学技術研究チームの宮脇敦史チームリーダー、平野雅彦研究員、安藤亮子研究員、杉山真由研究員、理研脳神経科学研究センター細胞機能探索技術研究チームの下薗哲研究員、黒川裕研究員、東北大学大学院生命科学研究科附属浅虫海洋生物学教育研究センターの竹田典代助教(研究特任)(研究当時、現日本学術振興会特別研究員)、北里大学大村智記念研究所の片山和彦教授、花王株式会社安全性科学研究所らの共同研究グループは、明るく極めて褪色[1]しにくい蛍光タンパク質「StayGold」を開発し、生細胞で細胞小器官の微細構造の動態を速く長く解析する定量的観察法を確立しました。また、StayGoldとVHH抗体[2]の融合タンパク質を作製し、固定感染細胞における新型コロナウイルスのスパイクタンパク質[3]の詳細な分布を明らかにしました。
本研究成果は、褪色による制限を取り払うことで、蛍光観察の時空間の幅を飛躍的に拡張し、定量性を求める創薬開発研究に貢献すると期待できます。
今回、共同研究グループは、「タマクラゲ[4]」の遺伝子発現解析データ[5]をもとに、野生型タマクラゲの緑色蛍光タンパク質を遺伝子クローニングし、明るく極めて褪色しにくい変異体StayGoldを創出しました。小胞体、ミトコンドリア、微小管などの細胞小器官をStayGoldで蛍光標識し、従来の蛍光タンパク質では褪色のために解析できなかった動的構造変化を明らかにしました。また、StayGoldを抗SARS-CoV-2スパイクタンパク質VHH抗体[2]に連結することで、感染細胞内でウイルス粒子が成熟する経路を捉えることに成功しました。
本研究は、科学雑誌『Nature Biotechnology』オンライン版(4月25日付:日本時間4月26日)に掲載されました。
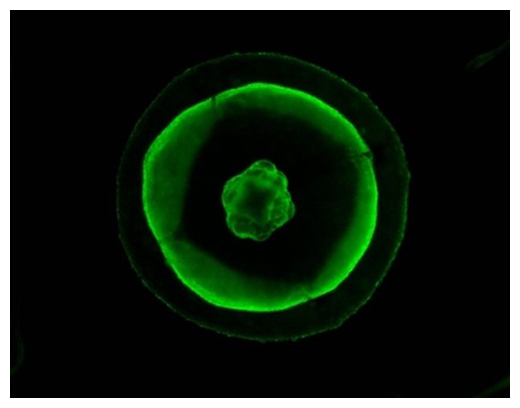
タマクラゲが放つ緑色の蛍光(青色光照射下で傘側から撮影、傘の外径は1.3mm)
背景
近年、オワンクラゲやナメクジウオ、サンゴ、イソギンチャクに由来する蛍光タンパク質で細胞内の小胞体やミトコンドリアなどの細胞小器官を蛍光標識し、生理的条件下で細胞小器官の挙動を鮮明に観察することが可能になっています。しかし蛍光タンパク質は、励起のための光を増強させると褪色し、そのシグナルが減弱・消滅するという欠点があります。蛍光タンパク質の褪色のせいでバイオイメージングの性能の幅が制限される状況にあり、褪色しにくい(光安定性が高い)実用的な蛍光タンパク質を開発することが重要課題として掲げられてきました。
しかし、蛍光タンパク質技術の開発者は、光安定性を追求すると暗くなり、逆に明るさを追求すると褪色しやすくなるといった具合に、光安定性と明るさとの間にあるトレードオフに悩まされてきました。これまで、明るさを追求するべく数多くの蛍光タンパク質変異体が開発されてきましたが、それらはほぼ全て光安定性を犠牲にしたものでした。
解決の糸口は「タマクラゲCytaeis uchidae」にありました(図1)。タマクラゲは刺胞動物[6]の一種で、生活環にポリプ[7]世代とクラゲ世代の両方を持ちます。ポリプ世代にはムシロガイの殻上に生息し、クラゲ世代には水の流れに身を任せて浮遊し、その両世代において緑の蛍光を発します。
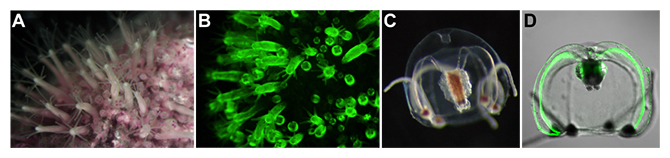
図1 タマクラゲの生活環
A、B:ムシロガイ上に生息するタマクラゲのポリプ群体。ポリプ世代はおよそ2mmの円柱を呈する。
C、D:浮遊するタマクラゲの雌。クラゲ世代は外径1~2mmの球体を呈する。
AとCは暗視野的に撮影した画像。Bは蛍光画像。Dは蛍光画像と微分干渉画像の重ね合わせ。
研究手法と成果
共同研究グループはトランスクリプトーム解析の結果を基に、タマクラゲから新しい緑色蛍光タンパク質CU17Sの遺伝子をクローニングすることに成功しました。CU17S遺伝子を大腸菌やヒト由来の培養細胞に導入したところ、非常に暗い緑色の蛍光を確認できました。また、暗いゆえに定量的評価が難しいのですが、CU17Sの褪色しにくい特性を察知しました。そこで、CUS17Sにランダム変異を導入したところ、非常に明るく極めて光安定性の高い変異体を作製することに成功し、この変異体を「StayGold」(明るくいつまでも輝き続けるという意味)と命名しました。明るさを考慮して、光安定性を絶対的褪色定量法[8]により定量評価したところ、StayGoldは既存の蛍光タンパク質と比べて10~100倍優れていることが分かりました(図2)。
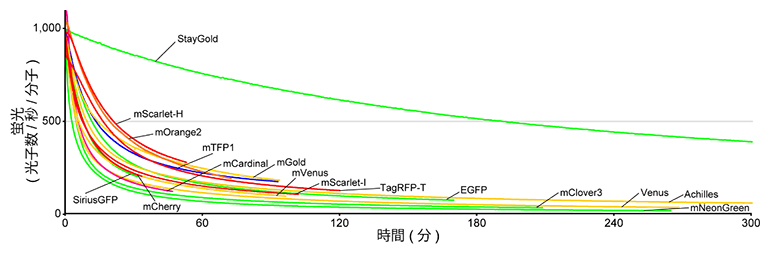
図2 明るさを考慮した褪色曲線
wide-field蛍光顕微鏡を使い、精製蛍光タンパク質に対してそれぞれの吸収極大に近い波長で連続的に光照射した。曲線の色は蛍光色を反映している。グラフの縦軸は、蛍光分子1個が1秒間に放出する光子の数。StayGoldの光安定性が際立つのがよく分かる。
次に、StayGoldを使って培養細胞の小胞体を蛍光標識し、連続的な照明の下、経時的な蛍光観察を行いました。その結果、細胞全体にわたる広い視野で長時間の高速観察ができることを確認しました。図3に、スピニングディスク型の共焦点顕微鏡[9]を用いた観察の結果を示しています。緑色蛍光タンパク質(GFP)で小胞体蛍光標識した細胞を比較対象としました。同程度の明るさの細胞を選び、およそ100秒間観察したところ、GFPの蛍光強度は半分以下になるのに対し、StayGoldはほとんど褪色しないことが分かりました。
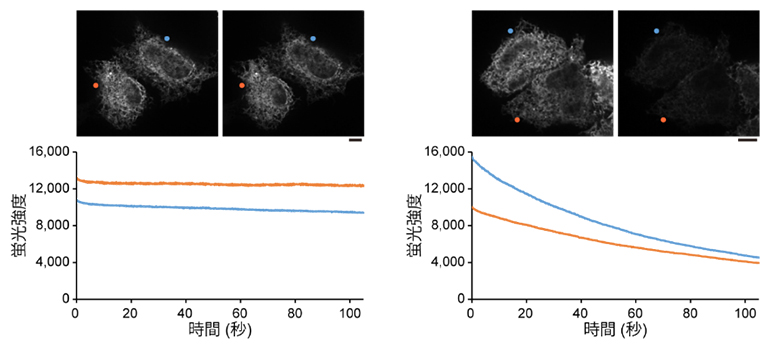
図3 小胞体に存在する蛍光タンパク質の褪色曲線(StayGold対GFPの比較)
培養細胞の小胞体の内腔をStayGold(左)または緑色蛍光タンパク質(GFP)(右)で標識し、スピニングディスク共焦点レーザー走査顕微鏡を用いて励起光を連続的に当てながら約100秒間観察した。観察の初めと終わりの画像を上に示す。グラフは細胞の蛍光強度の経時的変化を示す。StayGoldはほとんど褪色しないのに対し、GFPは半分程度に褪色した。スケールバーは10マイクロメートル(μm、1μmは1,000分の1mm)。
さらに共同研究グループは、StayGoldを使ってさまざまな細胞小器官の動態観察を試みました。例えば、最近、構造化照明顕微鏡(SIM)[10]という超解像光学顕微鏡を利用して、培養細胞の下面近くや周辺部分の小胞体を短時間局所的に高速観察する研究が報告されています。また、時空間的に分解能を高めることで、小胞体細管がおよそ10Hzで高速振動する様子が観察されています注1、2)。共同研究グループは、StayGoldを使って小胞体の観察範囲を細胞全体に広げるとともに、6分間にわたって持続的に行うことに成功しました。観察時間内に2回薬剤を投与することで一過性のカルシウムイオン上昇を誘起したところ、小胞体の細管網目構造の動きがカルシウムイオンによって緩和される様子が確認されました(図4)。
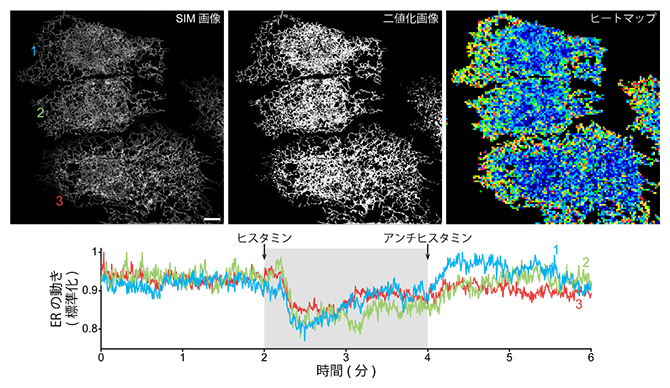
図4 小胞体細管網目構造の動きのカルシウムイオンによる制御
小胞体(ER)をStayGoldで蛍光標識し、隣接する三つのHeLa細胞(1、2、3とラベル)を構造化照明顕微鏡(SIM)で高速かつ長時間(6分間)観察した。観察開始後2分でヒスタミンを投与し、細胞内カルシウムイオン濃度を上げた。4分で抗ヒスタミン剤を投与し、細胞内カルシウム濃度を静止状態に戻した。SIM画像(上左)から二値化画像(上中)を作成し、全体を16画素四方のサブブロックに分割し、各サブブロックにおけるシグナル領域の変化量(n-1枚目とn枚目の差分)を自動的に数値化して、ヒートマップで表示した(上右)。カルシウムイオン濃度が上昇した2~4分の間で小胞体の動きが沈静化することが分かった。スケールバーは5μm。
注1)Nixon-Abell et al., Increased spatiotemporal resolution reveals highly dynamic dense tubular matrices in the peripheral ER. Science 354: aaf3928 (2016).
注2)Guo et al., Visualizing Intracellular Organelle and Cytoskeletal Interactions at Nanoscale Resolution on Millisecond Timescales. Cell 175: 1430-1442 (2018).
また、近年、ミトコンドリアの形態異常と神経変性や代謝疾患の関係が注目されています。StayGoldでミトコンドリアを蛍光標識し、細胞全体にわたる高速かつ長時間の超解像SIM観察を実現し、ミトコンドリアが頻繁に融合と分裂を繰り返す様子を包括的に観察しました(図5)。
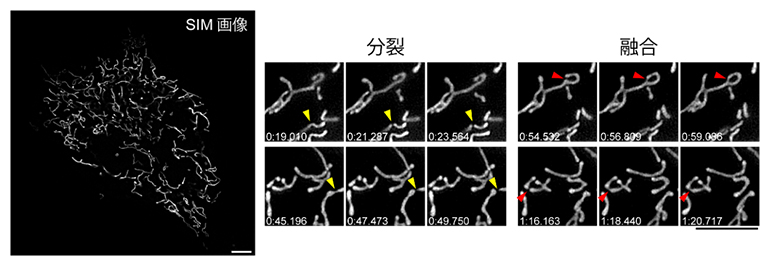
図5 ミトコンドリアの分裂と融合の観察
培養細胞のミトコンドリアのマトリックスをStayGoldで標識しSIMで観察した。数分の間に検出された分裂(黄色の矢頭)と融合(赤色の矢頭)の様子がよく分かる。スケールバーは5μm。
新型コロナウイルス感染症(COVID-19)によるパンデミックにより、StayGoldの開発研究に遅れが出ました。そこで共同研究グループは、新型コロナウイルス(SARS-CoV-2)を対象とするStayGold応用研究を試みました。一般的に、ウイルス構造タンパク質に対する抗体をベースにした抗原検査[11]は低感度性が問題点として指摘されていますが、StayGoldの明るさと光安定性を活用すれば高感度を達成できると考えました。
SARS-CoV-2の侵入によって、細胞の内膜系には大規模な改変が起こります(図6上)。これまで、ウイルスの核酸の複製に関わる内膜構造(DMVs:Double Membrane Vesicles)などは詳細に調べられてきました。一方、感染細胞内でウイルス粒子が構成され成熟し放出される様子はまだよく調べられていないことから、この過程の目印となるウイルス表面のスパイクタンパク質に注目しました。独自に開発した抗SARS-CoV-2スパイクタンパク質VHH抗体にStayGoldを遺伝子工学的に連結し、SARS-CoV-2スパイクタンパク質に結合する蛍光VHH抗体を作製しました。
SARS-CoV-2が感染した固定処理済みのVero細胞(アフリカミドリザル腎由来細胞)を蛍光VHH抗体で処理しSIM観察を行ったところ、スパイクタンパク質がたまるとされる小胞構造(宿主細胞内の出芽部位である小胞体-ゴルジ装置中間区画[ERGIC]の膜を利用して、SARS-CoV-2のエンベロープができる)の分布を高精細かつ包括的に解析することができました(図6下)。
z軸方向に焦点をずらしながら断層画像を取得し、ある3次元空間内の蛍光シグナルを再構成する体積イメージング[12]においても、StayGoldの高い光安定性が定量的な観測を可能にすることを確認しました。
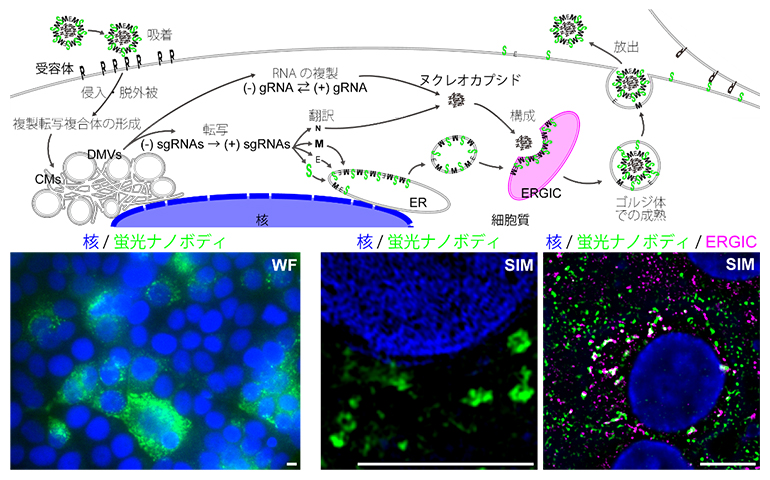
図6 SARS-CoV-2の感染機序と感染細胞におけるスパイクタンパク質のマッピング
(上) SARS-CoV-2の感染機序。翻訳により合成されたウイルスの四つの構造タンパク質を頭文字S、E、M、Nで表示。Sがスパイクタンパク質。ERは小胞体。ERGICは小胞体-ゴルジ装置中間区画。
(下左)蛍光ナノボディVHH抗体でSARS-CoV-2感染細胞をwide-field顕微鏡で観察した。感染細胞の集合および融合(合胞体)が観察された。
(下中)超解像SIM観察によって、中抜き構造(スパイク分子で裏打ちされる小胞構造)が可視化された。
(下右)蛍光VHH抗体のシグナルはERGICのマーカーと重なることが確認された。
全ての写真で、核は青、スパイク分子は緑で示されている。下右の写真で、ERGICはマゼンタで示され、スパイク分子と重なる部分は白色になる。スケールバーは5μm。
今後の期待
StayGoldにはいくつかの課題があります。まず、StayGoldは二量体を形成するため、そのままでは2価の結合部位を持つタグとして働き、標識分子の構造や機能に影響を及ぼす可能性があります。そこで、遺伝子工学的にStayGoldを直列に連結することで「tdStayGold」を作製し、微小管滑走分子やシナプス分子の効率の良い蛍光標識を可能にしました。結晶構造データをもとに二量体形成に関わるアミノ酸を他のアミノ酸に置換することで、単量体である「mStayGold」も開発中です。また、StayGoldはN末端とC末端が比較的短く、他のタンパク質に結合しにくい傾向があります。人工的に両末端を伸長することで、さまざまなタンパク質にうまく結合できるよう改変を試みています。
定量性を目指すさまざまな蛍光イメージングにおいて、色素の褪色は常に障害となります。経時的な観察やzスキャンを伴う体積イメージングでは、サンプルに繰り返し光を照射することが必須なため、多かれ少なかれ褪色問題が発生します。創薬研究などでレポーター遺伝子アッセイ[13]が盛んに行われていますが、このアッセイ用の蛍光タンパク質は二量体であってもそのまま単独で発現させることができます。よってStayGoldは、薬効評価など定量性を重視する分野で、直ちに活用されると期待できます。
褪色問題に対して蛍光標識をひたすら明るくし、シグナル量を稼ぐ対処法もありますが、許容量を超える蛍光タンパク質の過剰発現は、必然的に蛍光シグナルの氾濫や細胞機能の障害などの問題をもたらします。オワンクラゲGFPが生命科学に利用されるようになって四半世紀が経ちました。これまでは、ややもすれば明るさ偏重の傾向がありましたが、蛍光タンパク質の発現の量的制御がもっと議論されるべきだと考えられます。現在はゲノム編集技術[14]により、低コピー数での発現制御が可能となっています。一見、暗いと思われる蛍光標識産物を持続的に定量する観察技術が求められています。
共同研究グループは、StayGoldをめぐる共同研究の枠組みをさらに拡げ、細胞外小胞エキソソームや染色体構造タンパク質などの動態解析を開始しています。
補足説明
1.褪色
発色団は、可視域にある光を吸収することで色を作る構造単位である。蛍光タンパク質は自ら発色団を形成する。褪色は発色団が分解することで起こり、その結果不可逆的に色が消失する。色の消失によって必然的に蛍光も消失する。
2.VHH抗体、抗SARS-CoV-2スパイクVHH抗体
アルパカなどラクダ科の動物は、軽鎖のない重鎖のみから構成される抗体を産生する。重鎖抗体の可変領域はVHH(Variable domain of Heavy chain of Heavy chain)と呼ばれ、抗原を認識する最小のタンパク質断片として用いられる。北里大学の芳賀らの研究により、抗SARS-CoV-2スパイクVHH抗体を使って、SARS-CoV-2感染ハムスターの症状を軽減できることが示されている。
3.スパイクタンパク質
コロナウイルスの表面の突起物を形成する構造タンパク質。ウイルスはスパイクタンパク質を使って、宿主細胞上の受容体に結合して侵入する。スパイクタンパク質はワクチン開発のターゲットとなっている。
4.タマクラゲ
刺胞動物門、ヒドロ虫網、花クラゲ目に属する。クラゲ世代の個体は全体的に球状で外径は1~2mmのサイズ。研究室での飼育が可能で、生殖生物学の実験材料や理科教材として注目されている。下の写真は宮城教育大学での課外授業の様子。

2018年7月28日、宮城教育大学にて開催された課外授業の様子
小学生19名、中学生3名が参加した。
A、B:タマクラゲのライフサイクルを学んだ。
C:実体顕微鏡でタマクラゲの雄と雌の形態を観察し、スケッチした。
5.遺伝子発現解析データ
ここでは、特定の組織におけるメッセンジャーRNA(mRNA)の網羅的解析(トランスクリプトーム解析)によって得られたデータを指す。
6.刺胞動物
クラゲ、サンゴ、イソギンチャクの仲間。口を取り囲む触手に刺胞を備えている。
7.ポリプ
刺胞動物が呈する形態の一つで、基質上に定着して生活する。
8.絶対的褪色定量法
褪色の指標として「褪色の量子収率」がある。例えば、褪色の量子収率=10-6(100万分の1)の蛍光分子は、褪色するまでに平均106(100万)回の励起・緩和サイクルを回すことができると解釈される。ただし、この指標は明るさを考慮しない。2008年に、カリフォルニア大学サンディエゴ校のTsien研究室により、光安定性の定量的評価法が提案された。蛍光タンパク質の絶対的明るさ(モル吸光係数および蛍光量子収率)を考慮した評価法である。蛍光分子1個が1秒間に放出する光子数が1,000個から500個に半減するのにかかる時間を指標とする。
9.スピニングディスク型の共焦点顕微鏡
多数のピンホールがらせん状に並ぶ回転ディスクにレーザー光を照射し、標本をマルチビームで高速に多点走査して共焦点画像を作る顕微鏡。焦点面や体積を高速でイメージングする際に使われることが多い。一方、一般的な共焦点顕微鏡は標本をシングルビームで点走査するが、走査速度やレーザー強度などに依存して蛍光タンパク質の褪色の程度が非線形的に変わるので、StayGoldの性能評価は一般的な共焦点顕微鏡では十分に行っていない。様々な照明系で蛍光タンパク質の褪色を体系的に調べることは今後の課題である。
10.構造化照明顕微鏡(SIM)
構造化照明(高い空間周波数のパターン照明)で得られる干渉縞を利用して、微細構造情報を抽出する超解像顕微鏡。縞状パターンの照明を位相と角度を変えて複数枚の画像を取得し、画像演算によって1枚のSIM画像を得る。今回のSIM観察では、5位相×3角度で計15枚の画像から1枚のSIM画像を再構成した。15枚の画像取得中に褪色が起こると、正確な画像演算ができない。SIMはStructured Illumination Microscopyの略。
11.抗原検査
イムノクロマト法を原理として、新型コロナウイルスの構造タンパク質(スパイクタンパク質やヌクレオカプシドタンパク質)の有無を調べる簡易検査。
12.体積イメージング
z軸方向に沿ってある間隔でスキャンしながらxy断層画像を取得し、ある体積において蛍光シグナルを再構成するイメージング。2光子励起顕微鏡と光シート顕微鏡以外では、通常は焦点面の上下両方に照明光が当たるので、zスライスの数にほぼ比例してサンプルにおける照明量は増大し、褪色問題が発生しやすい。
13.レポーター遺伝子アッセイ
遺伝子発現の活性を蛍光や発光で可視化するアッセイ。蛍光タンパク質の最も基本的なアプリケーションといえる。
14.ゲノム編集技術
生物が元々持つ性質を改変する技術。ゲノムDNAの特定の塩基配列を狙って変化させることで達成する。
共同研究グループ
理化学研究所
脳神経科学研究センター 細胞機能探索技術開発チーム
光量子工学研究センター 生命光学技術研究チーム
チームリーダー 宮 脇敦史(みやわき あつし)
研究員 平野 雅彦(ひらの まさひこ)
研究員 安藤 亮子(あんどう りょうこ)
研究員 杉山 真由(すぎやま まゆ)
脳神経科学研究センター 細胞機能探索技術開発チーム
研究員 下薗 哲(しもぞの さとし)
研究員 黒川 裕(くろかわ ひろし)
専門職研究員 濱 裕(はま ひろし)
生命機能科学研究センター 細胞極性統御研究チーム
チームリーダー 岡田 康志(おかだ やすし)
(兼任 東京大学 大学院 理学研究系 理学部 教授)
東北大学 大学院生命科学研究科附属 浅虫海洋生物学教育研究センター
助教(研究特任)(研究当時) 竹田 典代(たけだ のりよ)
(現 日本学術振興会特別研究員)
宮城教育大学 教科内容学域 理数・生活科学部門
教授 出口 竜作(でぐち りゅうさく)
修士課程(研究当時) 遠藤 一樹(えんどう かずき)
(現 富谷市立成田小学校教諭)
北里大学 大村智記念研究所 ウイルス感染制御学
教授 片山 和彦(かたやま かずひこ)
特任助教 芳賀 慧(はが けい)
助手 戸高 玲子(とだか れいこ)
京都大学 物質―細胞統合システム拠点
特定准教授 藤原 敬宏(ふじわら たかひろ)
花王株式会 社安全性科学研究所 ウイルス制御プロジェクト
プロジェクトリーダー 森本 拓也(もりもと たくや)
研究員 稲浦 峻亮(いなうら しゅんすけ)
研究員 松村 佑太(まつむら ゆうた)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域(研究領域提案型)「共鳴誘導で革新するバイオイメージング(領域代表者:宮脇敦史)」「情報物理学でひもとく生命の秩序と設計原理(領域代表者:岡田康志)」、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」、理化学研究所理事長裁量経費、北里研究所「COVID-19対策北里プロジェクト」の支援を受けて行われました。
原論文情報
Masahiko Hirano, Ryoko Ando, Satoshi Shimozono, Mayu Sugiyama, Noriyo Takeda, Hiroshi Kurokawa, Ryusaku Deguchi, Kazuki Endo, Kei Haga, Reiko Takai-Todaka, Shunsuke Inaura, Yuta Matsumura, Hiroshi Hama, Yasushi Okada, Takahiro Fujiwara, Takuya Morimoto, Kazuhiko Katayama, Atsushi Miyawaki, “A highly photostable and bright green fluorescent protein”, Nature Biotechnology, 10.1038/s41587-022-01278-2
発表者
理化学研究所
脳神経科学研究センター 細胞機能探索技術研究チーム
光量子工学研究センター 生命光学技術研究チーム
チームリーダー 宮脇 敦史(みやわき あつし)
研究員 平野 雅彦(ひらの まさひこ)
研究員 安藤 亮子(あんどう りょうこ)
研究員 杉山 真由(すぎやま まゆ)
脳神経科学研究センター 細胞機能探索技術研究チーム
研究員 下薗 哲(しもぞの さとし)
研究員 黒川 裕(くろかわ ひろし)
東北大学 大学院生命科学研究科附属 浅虫海洋生物学教育研究センター
助教(研究特任)(研究当時) 竹田 典代(たけだ のりよ)
(現 日本学術振興会特別研究員)
北里大学 大村智記念研究所 ウイルス感染制御学
教授 片山 和彦(かたやま かずひこ)
花王株式会社 安全性科学研究所
プロジェクトリーダー 森本 拓也(もりもと たくや)
報道担当
理化学研究所 広報室 報道担当
東北大学 大学院生命科学研究科 広報室
学校法人北里研究所 総務部広報課
花王株式会社 PR戦略センター 企業PR戦略部