結晶成長を制御することで、さまざまな医薬品に応用可能 Controlling Crystal Growth Has Implications for Array of Medicines
2023-02-03 ヒューストン大学(UH)
◆バンドウイルカもまた、私たちの海岸を守るために活躍している海洋哺乳類なのです。高度に進化した探知能力を持つバンドウイルカは、米海軍の海洋哺乳類プログラムの一環として、数十年にわたって米海軍が水中地雷を発見するのを助けてきたのです。
◆ライマーはチームを代表して、互変異性体と呼ばれる尿酸塩の異性体を操作して尿酸アンモニウムの結晶成長を制御する方法を発見し、『Nature Communications』誌に発表しました。この発見は、イルカを助けるだけでなく、製薬業界にも影響を与える可能性があります。
◆”我々は、マイナー互変異性体として存在する尿酸塩のごく一部が、結晶化を完全に阻止できるほど結晶の成長速度を制御できることを発見しました “とライマーは述べています。”尿酸塩の濃度を上げると、突然、結晶化速度がほぼゼロになり、その領域では結晶が成長しないことを発見したのは、最も予想外で、驚くべきことでした。”
◆ライマーは、腎臓の濃度をその範囲にするために、食事コントロールによって、その結果を真似ることができるかもしれないと考えています。そうすれば、結晶成長が抑制され、薬が不要になる可能性があるのです。これはイルカも人間も同じですが、これについては今後の研究で明らかにします。
◆また、ライマーは尿酸塩の結晶を調べて、互変異性体が欠陥として結晶に取り込まれることを発見し、そこが医薬品に影響を与えることを明らかにした。
◆上位200種類の医薬品のうち、互変異性体の医薬品は33種類(腎臓結石の治療に用いられるアロプリノールも含む)あります。これらの医薬品は、HIV、てんかん、COVID-19、統合失調症、がん(皮膚がん、肺がん、膵臓がん)などで処方され、世界中で数百万人に影響を与えています。
◆「欠陥の少ない結晶を作ると溶解速度が遅く、欠陥の割合が多い結晶は溶解速度が速いのです」とライマーは言います。「医薬品を体内に入れるとき、その効果は溶解の速さに関係するからです。
<関連情報>
- https://uh.edu/news-events/stories/2023/february-2023/02032023-dolphin-research-leads-to-crystal-rx-rimer.php
- https://www.nature.com/articles/s41467-023-35924-3
互変異性による結晶化の自己抑制機構の解明 Tautomerism unveils a self-inhibition mechanism of crystallization
Weiwei Tang,Taimin Yang,Cristian A. Morales-Rivera,Xi Geng,Vijay K. Srirambhatla,Xiang Kang,Vraj P. Chauhan,Sungil Hong,Qing Tu,Alastair J. Florence,Huaping Mo,Hector A. Calderon,Christian Kisielowski,Francisco C. Robles Hernandez,Xiaodong Zou,Giannis Mpourmpakis & Jeffrey D. Rimer
Nature Communications Published:02 February 2023
DOI:https://doi.org/10.1038/s41467-023-35924-3
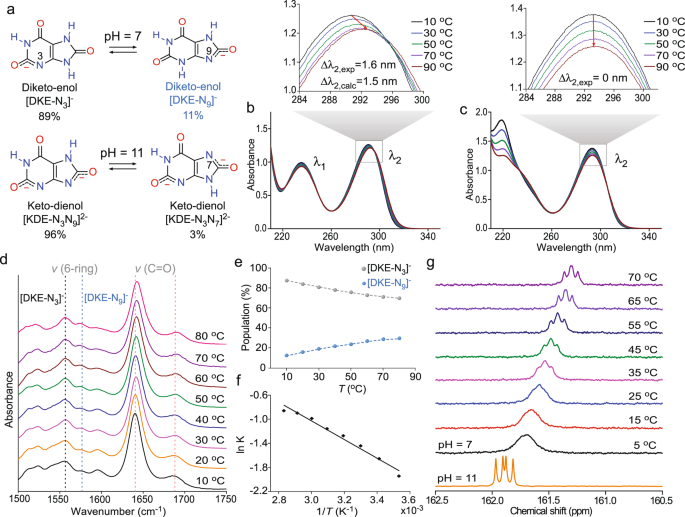
Abstract
Modifiers are commonly used in natural, biological, and synthetic crystallization to tailor the growth of diverse materials. Here, we identify tautomers as a new class of modifiers where the dynamic interconversion between solute and its corresponding tautomer(s) produces native crystal growth inhibitors. The macroscopic and microscopic effects imposed by inhibitor-crystal interactions reveal dual mechanisms of inhibition where tautomer occlusion within crystals that leads to natural bending, tunes elastic modulus, and selectively alters the rate of crystal dissolution. Our study focuses on ammonium urate crystallization and shows that the keto-enol form of urate, which exists as a minor tautomer, is a potent inhibitor that nearly suppresses crystal growth at select solution alkalinity and supersaturation. The generalizability of this phenomenon is demonstrated for two additional tautomers with relevance to biological systems and pharmaceuticals. These findings offer potential routes in crystal engineering to strategically control the mechanical or physicochemical properties of tautomeric materials.


