Walker-Warburg症候群や他の筋ジストロフィーの早期診断や治療につながる可能性がある。 Advance has potential for early diagnosis, treatments of Walker-Warburg syndrome, other muscular dystrophies
2023-03-09 テキサス A&M大学
研究チームは、遺伝的変異が神経細胞の接続に関与していることを発見し、ウォーカー・ウォーバーグ症候群などの疾患に対する新しい理解をもたらすことになった。
筋肉・目・脳症候群などの筋肉疾患は、幼い子供によく診断されるが、進行が早く、骨格筋、心臓、肺、脳、目、他の臓器に影響を与える。現在、これらの疾患の治療法は存在せず、患者は通常、成人に至る前に死亡する。
この研究は、ショウジョウバエを使用したモデルシステムを使用して行われ、米国立衛生研究所やテキサスA&M農業・生命科学大学の助成金が提供された。今後、脊椎筋ジストロフィーを含む神経疾患の研究は、複雑な糖質の役割に焦点を当てた研究を通じて進められることが期待される。
<関連情報>
- https://agrilifetoday.tamu.edu/2023/03/09/study-uncovers-aspect-of-how-muscular-dystrophies-progress/
- https://www.jbc.org/article/S0021-9258(23)00022-4/fulltext
プロテインチロシンホスファターゼ69Dは、ショウジョウバエの感覚軸索の配線に必要なプロテインO-マンノシルトランスフェラーゼ1-2の基質である Protein tyrosine phosphatase 69D is a substrate of protein O-mannosyltransferases 1-2 that is required for the wiring of sensory axons in Drosophila
Pedro Monagas-Valentin,Robert Bridger,Ishita Chandel,Melissa Koff,Boris Novikov,Patrick Schroeder,Lance Wells,Vladislav Panin
Journal of Biological Chemistry Received in revised form: December 29, 2022
DOI:https://doi.org/10.1016/j.jbc.2023.102890

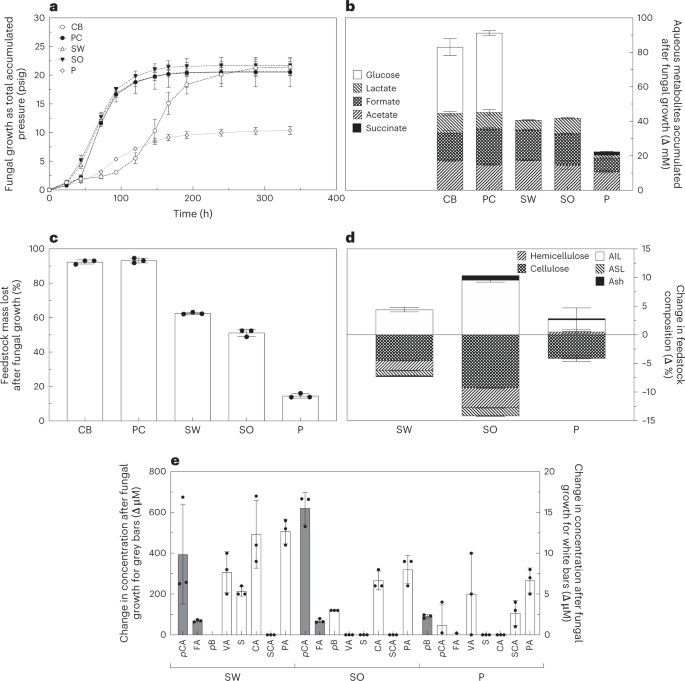
Mutations in protein O-mannosyltransferases (POMTs) result in severe brain defects and congenital muscular dystrophies characterized by abnormal glycosylation of α-dystroglycan (α-Dg). However, neurological phenotypes of POMT mutants are not well understood, and the functional substrates of POMTs other than α-Dg remain unknown. Using a Drosophila model, here we reveal that Dg alone cannot account for the phenotypes of POMT mutants, and identify Protein tyrosine phosphatase 69D (PTP69D) as a gene interacting with POMTs in producing the abdomen rotation phenotype. Using RNAi-mediated knockdown, mutant alleles, and a dominant-negative form of PTP69D, we reveal that PTP69D is required for the wiring of larval sensory axons. We also found that PTP69D and POMT genes interact in this process, and that their interactions lead to complex synergistic or antagonistic effects on axon wiring phenotypes, depending on the mode of genetic manipulation. Using glycoproteomic approaches, we further characterized the glycosylation of the PTP69D transgenic construct expressed in genetic strains with different levels of POMT activity. We found that the PTP69D construct carries many O-linked mannose modifications when expressed in Drosophila with wild-type or ectopically upregulated expression of POMTs. These modifications were absent in POMT mutants, suggesting that PTP69D is a substrate of POMT-mediated O-mannosylation. Taken together, our results indicate that PTP69D is a novel functional substrate of POMTs that is required for axon connectivity. This mechanism of POMT-mediated regulation of receptor-type protein tyrosine phosphatase functions could potentially be conserved in mammals and may shed new light on the etiology of neurological defects in muscular dystrophies.