生物物理学者は、人工細胞への道を開く重要な一歩となる、新しい細胞様輸送システムを設計しました。Biophysicists have designed a new cell-like transport system that represents an important milestone on the road to artificial cells.
2023-05-15 ミュンヘン大学(LMU)
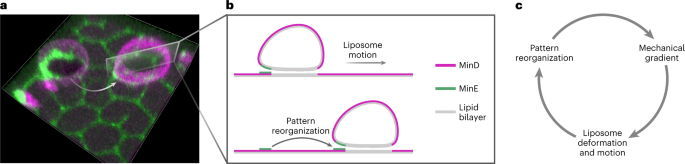
◆この運動は、小胞膜が特定のタンパク質パターンと相互作用することによって推進されます。この相互作用には生化学的な「燃料」であるATPが必要です。これらのパターンは、E. coli菌において細胞分裂を制御するMinタンパク質系と呼ばれる既知の生物学的パターン形成システムによって生成されます。
◆Schwille氏の研究室での実験では、人工系における膜結合Minタンパク質が小胞周りに非対称に配置され、それらと相互作用して運動を引き起こすことが示されました。この過程で、タンパク質は支持膜だけでなく、小胞自体にも結合します。理論的な分析の助けを借りて、Frey教授のチームは、この運動の背後にある2つの異なるメカニズムを特定しました。
<関連情報>
- https://www.lmu.de/en/newsroom/news-overview/news/synthetic-biology-proteins-set-vesicles-in-motion.html
- https://www.nature.com/articles/s41567-023-02058-8
メカノケミカルフィードバックループがリポソームの持続的な運動を駆動する Mechanochemical feedback loop drives persistent motion of liposomes
Meifang Fu,Tom Burkart,Ivan Maryshev,Henri G. Franquelim,Adrián Merino-Salomón,María Reverte-López,Erwin Frey & Petra Schwille
Nature Physics Published:15 May 2023
DOI:https://doi.org/10.1038/s41567-023-02058-8
Abstract
Achieving autonomous motion is a central objective in designing artificial cells that mimic biological cells in form and function. Cellular motion often involves complex multiprotein machineries, which are challenging to reconstitute in vitro. Here we achieve persistent motion of cell-sized liposomes. These small artificial vesicles are driven by a direct mechanochemical feedback loop between the MinD and MinE protein systems of Escherichia coli and the liposome membrane. Membrane-binding Min proteins self-organize asymmetrically around the liposomes, which results in shape deformation and generates a mechanical force gradient leading to motion. The protein distribution responds to the deformed liposome shape through the inherent geometry sensitivity of the reaction–diffusion dynamics of the Min proteins. We show that such a mechanochemical feedback loop between liposome and Min proteins is sufficient to drive continuous motion. Our combined experimental and theoretical study provides a starting point for the future design of motility features in artificial cells.


